题目内容
【题目】氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。
Ⅰ.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:6ZnFe2O4![]() 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O
6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O![]() 3ZnFe2O4+H2↑
3ZnFe2O4+H2↑
(1)ZnFe2O4中Fe的化合价为_____。
(2)该循环制氢中不断消耗的物质是_____(填化学式),得到H2和O2的质量比为_____。
Ⅱ.贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+3H2![]() 3MgH2+MgCu2。
3MgH2+MgCu2。
(1)熔炼制备Mg2Cu合金时,通入氩气的目的是_____。
(2)氢化物MgH2与水反应生成一种碱,并释放出H2。其化学反应方程式为_____。
(3)11.2gMg2Cu完全吸氢后所得混合物与过量盐酸反应,放出H2的质量为_____g。
【答案】+3 H2O 1:8 防止金属被氧化 ![]() 0.7
0.7
【解析】
Ⅰ:(1)ZnFe2O4中锌的化合价为+2价,氧元素的化合价为-2,设Fe的化合价为x,则有(+2)+2x+(-2)×4=0,x=+3。
(2)该循环制氢中不断消耗的物质是水,其化学式为H2O,得到H2和O2的质量比为4:32=1:8;
Ⅱ:(1)熔炼制备Mg2Cu合金时,通入氩气可以起到保护作用,防止金属被氧化。
(2)氢化物MgH2与水反应生成氢氧化镁,并释放出H2.其化学反应方程式为![]() ;
;
(3)11.2gMg2Cu完全吸氢后所得混合物与过量盐酸反应,其中的氢化镁与水反应生成氢氧化镁和氢气,MgCu2中只有镁与盐酸反应产生氢气,

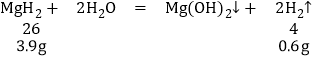
7.6gMgCu2含有镁的质量为:![]()
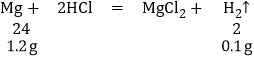
故生成氢气的质量为:0.6g+0.1g=0.7g

 名校课堂系列答案
名校课堂系列答案