题目内容
为测定某粉末状黄铜(即Cu—Zn合金)样品中铜锌的组成,某同学取样品9.75g放入烧杯中,再取40g稀盐酸溶液分四次加入烧杯中,充分反应后实验数据如下:
(1)9.75g黄铜样品中铜的质量 g;
(2)计算9.75g黄铜与稀盐酸完全反应共放出多少克氢气?(写出解题过程)
(3)第三次加入的稀盐酸与黄铜中的锌 (填“是”或“不是”) 恰好完全反应,理由: 。
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 加稀盐酸的质量(g) | 10 | 10 | 10 | 10 |
| 剩余固体质量(g) | 9.10 | 8.45 | 7.80 | 7.80 |
(2)计算9.75g黄铜与稀盐酸完全反应共放出多少克氢气?(写出解题过程)
(3)第三次加入的稀盐酸与黄铜中的锌 (填“是”或“不是”) 恰好完全反应,理由: 。
(1)7.80
(2)解:设9.75g黄铜与盐酸反应共放出氢气的质量为x。
Zn + 2HCl = ZnCl2 + H2↑
65 2
(9.75-7.80)g x
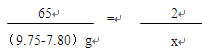
x=0.06g
答:9.75g黄铜与盐酸反应共放出氢气的质量为0.06g。
(3)是(1分) 由于第一次加入10g盐酸固体减少的质量是9.75g﹣9.1g=0.65g,第二次反应消耗锌的质量=9.10g﹣8.45g=0.65g,每加入10g盐酸可消耗锌的质量为0.65g,所以可知到第三次时10g盐酸恰好能反应掉样品中的锌。
(2)解:设9.75g黄铜与盐酸反应共放出氢气的质量为x。
Zn + 2HCl = ZnCl2 + H2↑
65 2
(9.75-7.80)g x
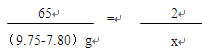
x=0.06g
答:9.75g黄铜与盐酸反应共放出氢气的质量为0.06g。
(3)是(1分) 由于第一次加入10g盐酸固体减少的质量是9.75g﹣9.1g=0.65g,第二次反应消耗锌的质量=9.10g﹣8.45g=0.65g,每加入10g盐酸可消耗锌的质量为0.65g,所以可知到第三次时10g盐酸恰好能反应掉样品中的锌。
试题分析:由题意得:
(1)黄铜中锌能与盐酸反应,而铜不能,故9.75g黄铜样品中铜的质量7.80g。
(2)设,9.75g黄铜与稀盐酸完全反应共放出氢气的质量为x。
Zn + 2HCl = ZnCl2 + H2↑
65 2
(9.75-7.80)g x
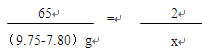
x=0.06g
答:9.75g黄铜与盐酸反应共放出氢气的质量为0.06g。
(3)第三次加入的稀盐酸与黄铜中的锌是恰好完全反应,理由是:由于第一次加入10g盐酸固体减少的质量是9.75g﹣9.1g=0.65g,第二次反应消耗锌的质量=9.10g﹣8.45g=0.65g,每加入10g盐酸可消耗锌的质量为0.65g,所以可知到第三次时10g盐酸恰好能反应掉样品中的锌。
点评:本题难度较大,首先要分析得出锌的活动性强于氢,能与盐酸反应,生成氢气;而铜的活动性弱与氢,不能与盐酸反应;然后根据锌的质量求解氢气的质量。
根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答。

练习册系列答案
相关题目
 2NaOH+ Cl2↑+ H2↑。现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?
2NaOH+ Cl2↑+ H2↑。现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?