题目内容
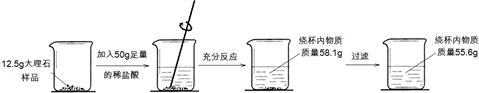
(3分)某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
2%
试题分析:根据混合时所发生的反应Na2CO3 + Ca(OH)2 ="=" CaCO3↓+ 2NaOH,可知恰好完全反应后所得溶液为氢氧化钠溶液,此时溶液的溶质质量分数=
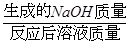 ×100%,反应后溶液的质量可根据质量守恒定律,由反应前混合物的质量总和减去生成的沉淀碳酸钙而求得,故只需要用碳酸钠的质量表示出生成的氢氧化钠的质量和形成沉淀的质量,即可利用反应后溶液中的溶质的质量分数的公式和质量守恒定律,计算出碳酸钠的质量,再使用溶质的质量分数计算公式计算出原碳酸钠溶液的溶质质量分数即可。
×100%,反应后溶液的质量可根据质量守恒定律,由反应前混合物的质量总和减去生成的沉淀碳酸钙而求得,故只需要用碳酸钠的质量表示出生成的氢氧化钠的质量和形成沉淀的质量,即可利用反应后溶液中的溶质的质量分数的公式和质量守恒定律,计算出碳酸钠的质量,再使用溶质的质量分数计算公式计算出原碳酸钠溶液的溶质质量分数即可。解:设原碳酸钠溶液中溶质的质量为x
Na2CO3 + Ca(OH)2 ="=" CaCO3↓+ 2NaOH
106 100 80
x
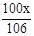
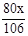
则
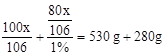
解得,x ="10.6" g
所以加入的碳酸钠溶液中溶质的质量分数为
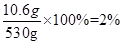
答:加入的碳酸钠溶液中溶质的质量分数为2%。
点评:此题是关于化学方程式及溶质质量分数的计算题,要求学生有较强的分析能力;解题的关键是要明确所求溶液的溶质是什么,然后根据相关的化学反应方程式,并依据各物质间存在的固定的质量比求解计算即可,注意解题要规范。

练习册系列答案
相关题目