题目内容
【题目】化学兴趣小组在探究金属与酸的反应时,观察到镁、锌、铁分别与稀盐酸反应产生气泡速率不同。某同学提出问题:影响化学反应速率的因素有哪些?化学兴趣小组运用以下试剂对影响化学反应速率的因素开展探究活动。
提供试剂:15%的稀盐酸、15%的稀盐酸、铝粉、铁粉、铝片
(提出问题)影响化学反应速率的因素有哪些?
(猜想与假设)
猜想1:物质的性质;猜想2:反应的温度;
猜想3:反应物的浓度;猜想4:___________。
(实验探究)(实验中只能使用提供的试剂)
实验 | 实验操作 | 实验现象 | 实验结论 |
验证猜想1 | 分别向盛有等体积的______两支试管中加入等体积的 15%的稀盐酸 | 盛有_______的试管中产气泡更快 | 物质的性质影响反应速率 |
验证猜想2 | 分别向盛有等体积的铁粉的两支试管中加入等体积的15%的稀盐酸,加热其中一支试管 | 加热试管中产生气泡更快 | 温度越_____,反应速率越快 |
验证猜想3 | 向盛有等质量铁粉的两支试管分别加入__________ | 加入_____试管中产生气泡更快 | 反应物的浓度越大,反应速率越快 |
验证猜想4 | 分别向盛有等质量铝粉和铝片试管中加入等体积5%的稀盐酸 | 盛有铝粉的试管中产生气泡更快 | ________,应速率越快 |
(实验拓展)兴趣小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化(如下图所示)。下列有关说法正确的是___(填序号)。
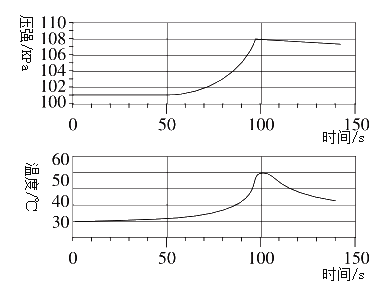
A 铝与盐酸反应吸收热量 B 50s时,溶液中的溶质为AlCl3
C 0~50 s,铝与盐酸反应 D 100~140s,压强减小是因为温度降低
【答案】反应物间的接触面积 铝粉、铁粉 铝粉 高 5%的稀盐酸、15%的稀盐酸 15%的稀盐酸 反应物间的接触面积越大 D
【解析】
[猜想与假设]
化学反应的反应速率可能与反应物的接触面积、反应温度、反应物的自身的性质、反应物的浓度等条件相关。故答案为:反应物的接触面积;
[实验探究]
实验1:为了探究物质自身的性质是否会影响化学反应速率,则可以设计实验,只改变反应物的种类,其余条件不变,控制变量。则可以选择铝粉和铁粉和15%的稀盐酸,进行实验,观察气泡产生的速率。当观察到铝粉产生的气泡速度快,则证明化学反应速率和物质的性质有关。故答案为:铝粉和铁粉、铝粉;
实验2:为了探究温度对反应速率的影响,则应该准备等体积的铁粉和等体积的稀盐酸混合,并且加热其中的一支试管,若观察到加热的试管产生气泡的速度比没加热的快,则可以证明化学反应速率和温度有关。故答案为:高;
实验3:为了探究反应物浓度对反应速率的影响,则应该准备等质量的铁粉和不同浓度的稀盐酸进行实验。若观察到浓度高的稀盐酸,产生气泡的速度偏快,则可以证明化学反应速率和反应物浓度有关。故答案为:5%的稀盐酸,15%的稀盐酸、15%的稀盐酸;
实验4:为了探究反应物之间的接触面积对反应速率的影响,则应该准备铝片和铝粉和等浓度的稀盐酸。由于铝粉和稀盐酸的接触面积大,若铝粉产生气体的速度比铝片的快,则可以证明化学反应速率与反应物接触面积有关。故答案为:反应物间的接触面积越大;
[实验拓展]
未打磨的铝片表面有一层致密的氧化铝薄膜。则将未打磨的铝片放入到盐酸中,结合图像可知,前50s,稀盐酸和氧化铝反应,装置内的温度、压强无明显变化,50s后,铝和盐酸反应放出热量生成氢气,使溶液的温度升高、装置内压强增大。由于反应结束后,温度逐渐冷却到室温,则温度降低,气体分子之间的间隔也会减小,从而导致压强会变小。
A、通过图像可知,铝和盐酸反应放出热量,温度升高。A错误;
B、50s时,铝和盐酸开始反应,并且是将铝放入到盐酸中,此时溶液中酸过量,则溶液应该含有氯化铝和盐酸。B错误;
C、根据分析可知,0-50s时,氧化铝和盐酸反应。C错误;
D、通过分析可知,100s后,装置内压强降低,是因为铝和盐酸反应结束后,温度下降的原因。D正确。
故答案为:D。

 阅读快车系列答案
阅读快车系列答案