题目内容
【题目】根据下列实验装置图,回答问题:
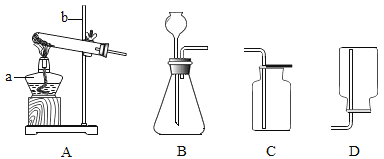


(1)A中仪器b的名称是_________________,制备氧气的化学方程式为_________________。
(2)收集二氧化碳时可选用装置是_______________(填字母序号)。
(3)若小亮改用装置F来制取CO2,用它代替B装置的优点是可以控制_________________。
(4)G是电解水的简易装置,其中连接正极的是________________(填 “A”或“B”)。
【答案】铁架台 2KClO3![]() 2KCl+3O2↑ C 反应发生停止 A
2KCl+3O2↑ C 反应发生停止 A
【解析】
(1)由图可知,b为铁架台,A装置试管内没有放棉花,可用于氯酸钾制氧气的发生装置,化学方程式为2KClO3![]() 2KCl+3O2↑,故填:铁架台;2KClO3
2KCl+3O2↑,故填:铁架台;2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
(2)二氧化碳密度比空气大能溶于水,只能用向上排空气法收集,故填:C。
(3)F装置固体药品可以上下移动,下移进入液体中反应发生,上移和液体分开反应停止,故可控制反应发生停止,故填:反应发生停止。
(4)水电解正极生成氧气,负极生成氢气,体积比为1:2,故正极连接A,故填:A。

【题目】化学兴趣小组在探究金属与酸的反应时,观察到镁、锌、铁分别与稀盐酸反应产生气泡速率不同。某同学提出问题:影响化学反应速率的因素有哪些?化学兴趣小组运用以下试剂对影响化学反应速率的因素开展探究活动。
提供试剂:15%的稀盐酸、15%的稀盐酸、铝粉、铁粉、铝片
(提出问题)影响化学反应速率的因素有哪些?
(猜想与假设)
猜想1:物质的性质;猜想2:反应的温度;
猜想3:反应物的浓度;猜想4:___________。
(实验探究)(实验中只能使用提供的试剂)
实验 | 实验操作 | 实验现象 | 实验结论 |
验证猜想1 | 分别向盛有等体积的______两支试管中加入等体积的 15%的稀盐酸 | 盛有_______的试管中产气泡更快 | 物质的性质影响反应速率 |
验证猜想2 | 分别向盛有等体积的铁粉的两支试管中加入等体积的15%的稀盐酸,加热其中一支试管 | 加热试管中产生气泡更快 | 温度越_____,反应速率越快 |
验证猜想3 | 向盛有等质量铁粉的两支试管分别加入__________ | 加入_____试管中产生气泡更快 | 反应物的浓度越大,反应速率越快 |
验证猜想4 | 分别向盛有等质量铝粉和铝片试管中加入等体积5%的稀盐酸 | 盛有铝粉的试管中产生气泡更快 | ________,应速率越快 |
(实验拓展)兴趣小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化(如下图所示)。下列有关说法正确的是___(填序号)。
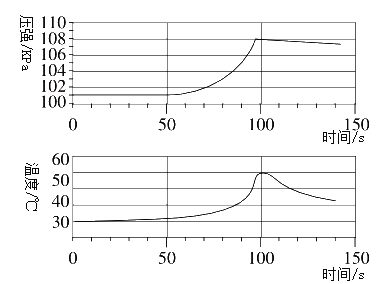
A 铝与盐酸反应吸收热量 B 50s时,溶液中的溶质为AlCl3
C 0~50 s,铝与盐酸反应 D 100~140s,压强减小是因为温度降低
【题目】火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”成分进行探究。请你回答下列问题:
(查阅资料)
a 固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成的。
b 氯化钙、氯化钡溶液均呈中性。
(提出问题)
(1)酒精中是否含有碳元素?
(2)固体酒精中的氢氧化钠是否变质?
(实验探究)
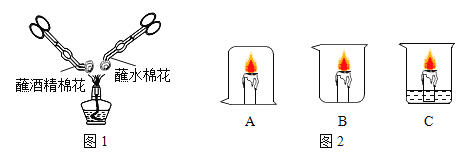
(1)按如图所示进行实验,发现烧杯内壁有一层白膜,可得出酒精中含有_______________元素;

(2)取少量固体酒精于烧杯中,加足量的水充分溶解后静置,观察到____现象,由此说明氢氧化钠已变质。氢氧化钠变质的化学方程式为__________;
(3)为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按下列方案进行实验。
实验操作 | 实验现象 | 实验结论 |
向一支试管中滴加酚酞溶液 | 溶液变红 | 清液中有氢氧化钠 |
向另一支试管中滴加澄清石灰水 | 产生白色沉淀 | 清液中有____ |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是____;
他们另取烧杯中的上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思与交流)乙组实验中加足量氯化钡溶液的目的是__________________;
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。