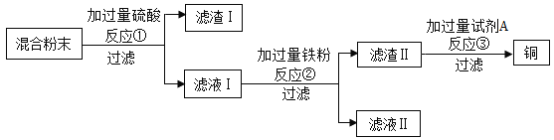
题目内容
【题目】化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法,请回答有关问题:
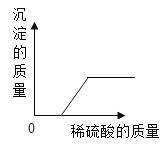
(1)甲同学:取50g废水于烧杯中,逐渐滴入溶质质量分数为20%的NaOH溶液,反应过程溶液pH变化如图
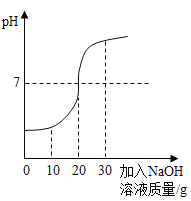
①50g废水中H2SO4的质量是多少?写出计算过程.
②当加入30g NaOH溶液时,烧杯中的溶质为 (填化学式).
(2)乙同学:改用BaCl2溶液代替NaOH溶液测定废水中的H2SO4的含量,结果可能会 (填“偏高”、“偏低”、“不变”),理由是 .
【答案】(1)①4.9g ②Na2SO4、NaOH (2)偏高 BaCl2溶液也会与废水中的Na2SO4反应
【解析】
(1)由图可知,加入20gNaOH溶液时,溶液的pH=7,表明氢氧化钠与硫酸恰好完全反应,则参加反应的氢氧化钠的质量=20g×20%=4g
设废水中硫酸的质量为x
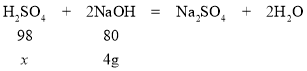
98:80=x:4g
x=4.9g
答:废水中硫酸的质量为4.9g。
(2)由图可知,当加入30g NaOH溶液,溶液的pH值大于7,说明氢氧化钠溶液过量,所以当加入30g NaOH溶液时,烧杯中的溶质为反应生成的Na2SO4和剩余的NaOH,故填Na2SO4、NaOH。
(3)氯化钡溶液既可以和硫酸反应生成硫酸钡沉淀,也可以和硫酸钠溶液反应生成硫酸钡沉淀,消耗的氯化钡溶液的质量较多,所以会导致测定结果偏高,故答案为偏高,BaCl2溶液也会与废水中的Na2SO4反应。

 阅读快车系列答案
阅读快车系列答案【题目】化学兴趣小组在探究金属与酸的反应时,观察到镁、锌、铁分别与稀盐酸反应产生气泡速率不同。某同学提出问题:影响化学反应速率的因素有哪些?化学兴趣小组运用以下试剂对影响化学反应速率的因素开展探究活动。
提供试剂:15%的稀盐酸、15%的稀盐酸、铝粉、铁粉、铝片
(提出问题)影响化学反应速率的因素有哪些?
(猜想与假设)
猜想1:物质的性质;猜想2:反应的温度;
猜想3:反应物的浓度;猜想4:___________。
(实验探究)(实验中只能使用提供的试剂)
实验 | 实验操作 | 实验现象 | 实验结论 |
验证猜想1 | 分别向盛有等体积的______两支试管中加入等体积的 15%的稀盐酸 | 盛有_______的试管中产气泡更快 | 物质的性质影响反应速率 |
验证猜想2 | 分别向盛有等体积的铁粉的两支试管中加入等体积的15%的稀盐酸,加热其中一支试管 | 加热试管中产生气泡更快 | 温度越_____,反应速率越快 |
验证猜想3 | 向盛有等质量铁粉的两支试管分别加入__________ | 加入_____试管中产生气泡更快 | 反应物的浓度越大,反应速率越快 |
验证猜想4 | 分别向盛有等质量铝粉和铝片试管中加入等体积5%的稀盐酸 | 盛有铝粉的试管中产生气泡更快 | ________,应速率越快 |
(实验拓展)兴趣小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化(如下图所示)。下列有关说法正确的是___(填序号)。
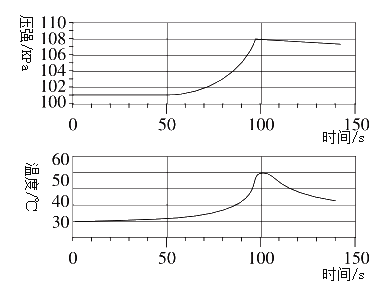
A 铝与盐酸反应吸收热量 B 50s时,溶液中的溶质为AlCl3
C 0~50 s,铝与盐酸反应 D 100~140s,压强减小是因为温度降低