题目内容
【题目】如下图所示,甲、乙、丙烧杯中均盛有等质量、等质量分数的稀硫酸,将形状、大小均相同的三种金属片Zn、X、Cu分别放入其中,请根据图示回答。
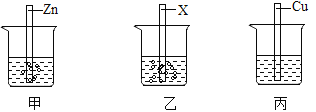
(1)Zn、X、Cu三种金属的活动性强弱顺序为_____。
(2)写出甲烧杯中发生反应的化学方程式:_____。
(3)将上述实验中的金属X更换为Ag,要验证Zn、Ag、Cu的金属活动性顺序,可将上图烧杯中的稀硫酸更换为_____溶液。
【答案】X>Zn>Cu Zn+H2SO4 =ZnSO4 +H2↑ CuSO4(或CuCl2 或Cu(NO3)2 )
【解析】
(1)由图示可知,Zn、X能与稀硫酸反应,X与稀硫酸的反应比Zn的反应剧烈,Cu不与稀硫酸反应,所以三种金属的活动性强弱顺序为:X>Zn>Cu。
(2)甲烧杯中发生反应是锌与稀硫酸反应生成了硫酸锌和氢气,反应的化学方程式是:Zn+H2SO4 =ZnSO4 +H2↑。
(3)将上述实验中的金属X更换为Ag,要验证Zn、Ag、Cu的金属活动性顺序,可以利用“三取中”的实验方法,已有了金属的单质,可以可将上图烧杯中的稀硫酸更换铜盐,如CuSO4(或CuCl2 或Cu(NO3)2 )溶液即可。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学兴趣小组在探究金属与酸的反应时,观察到镁、锌、铁分别与稀盐酸反应产生气泡速率不同。某同学提出问题:影响化学反应速率的因素有哪些?化学兴趣小组运用以下试剂对影响化学反应速率的因素开展探究活动。
提供试剂:15%的稀盐酸、15%的稀盐酸、铝粉、铁粉、铝片
(提出问题)影响化学反应速率的因素有哪些?
(猜想与假设)
猜想1:物质的性质;猜想2:反应的温度;
猜想3:反应物的浓度;猜想4:___________。
(实验探究)(实验中只能使用提供的试剂)
实验 | 实验操作 | 实验现象 | 实验结论 |
验证猜想1 | 分别向盛有等体积的______两支试管中加入等体积的 15%的稀盐酸 | 盛有_______的试管中产气泡更快 | 物质的性质影响反应速率 |
验证猜想2 | 分别向盛有等体积的铁粉的两支试管中加入等体积的15%的稀盐酸,加热其中一支试管 | 加热试管中产生气泡更快 | 温度越_____,反应速率越快 |
验证猜想3 | 向盛有等质量铁粉的两支试管分别加入__________ | 加入_____试管中产生气泡更快 | 反应物的浓度越大,反应速率越快 |
验证猜想4 | 分别向盛有等质量铝粉和铝片试管中加入等体积5%的稀盐酸 | 盛有铝粉的试管中产生气泡更快 | ________,应速率越快 |
(实验拓展)兴趣小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化(如下图所示)。下列有关说法正确的是___(填序号)。
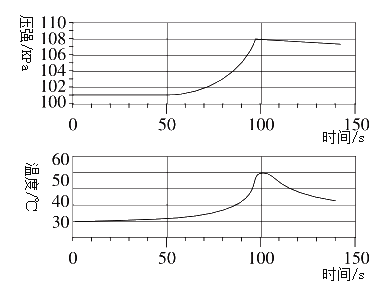
A 铝与盐酸反应吸收热量 B 50s时,溶液中的溶质为AlCl3
C 0~50 s,铝与盐酸反应 D 100~140s,压强减小是因为温度降低