题目内容
现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取该样品10g,并用如图所示的装置进行实验,得到如下两组数据:
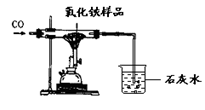
试回答:
(1)你认为应选择 组的实验数据来计算样品中氧化铁的质量分数,计算结果为 。
(2)这位同学所用的实验装置的不足之处 。

| | 反应前 | 氧化铁完全反应后 |
| A组 | 玻璃管和氧化铁样品的质量43.7g | 玻璃管和固体的质量41.3g |
| B组 | 烧杯和澄清石灰水的质量180g | 烧杯和烧杯中物质的质量186.8g |
(1)你认为应选择 组的实验数据来计算样品中氧化铁的质量分数,计算结果为 。
(2)这位同学所用的实验装置的不足之处 。
(1)A 80% (2)缺少尾气处理装置
试题分析:(1)应该用A组数据计算,不用B组数据,是因为不知氢氧化钙溶液是否足量,即无法确定反应过程中生成的二氧化碳是否被石灰水完全吸收完,也就不知道二氧化碳的质量,所以无法计算。
因为反应前玻璃管和固体样品的质量是43.7g,反应结束后玻璃管和固体样品的质量是41.3g,故固体物质质量减少2.4g;根据反应的原理可知,减少的质量为参加反应的氧化铁中氧元素的质量,据此计算。
设该反应中参加反应的 Fe2O3的质量为x,
3CO+Fe2O3
 2Fe+3CO2 固体减少的质量△
2Fe+3CO2 固体减少的质量△160 112 160-112=48
x 2.4g
160:48=x:2.4g
解得,x=8
所以药品中Fe2O3的质量分数=
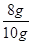 ×100%=80%
×100%=80%(2)由于CO有毒,不能直接排入空气中,否则会对空气造成污染,故需要尾气处理装置,而该实验没有。
点评:熟练掌握一氧化碳还原氧化铁的实验原理、操作及注意事项等是解题的关键,关于实验数据的处理,是本题的难点,而解答的关键是二氧化碳是否能被完全吸收。

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目