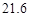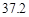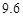题目内容
某兴趣小组的同学发现,上个月做实验用的氢氧化钠溶液忘记了塞上瓶塞。这瓶溶液有没有变质呢?同学们想一探究竟,请你和他们一起参与。
【查阅资料】氯化钡溶液显中性。
【提出猜想】假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液 变质。
【实验验证】
【讨论交流】
(1)步骤①滴加过量的氯化钡溶液的目的是 ;
(2)有同学提出用氢氧化钡溶液代替氯化钡溶液做同样的实验,也能看到相同的现象,得出相同的结论。你同意他的观点吗?为什么?
, 。
【反思】氢氧化钠敞口放置变质的原因是 (用化学方程式表示),因此氢氧化钠应 保存。
【定量研究】
从该瓶中取出一定量的溶液,向其中加入含7.4g氢氧化钙的石灰水,恰好完全反应,过滤,将滤液蒸干,得到12g白色固体。则所取的溶液中含碳酸钠和氢氧化钠的质量分别是多少克?
【查阅资料】氯化钡溶液显中性。
【提出猜想】假设一:该溶液没有变质;
假设二:该溶液部分变质;
假设三:该溶液 变质。
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量该溶液于试管中,向其中滴加过量的氯化钡溶液; | 生成白色沉淀 | 假设 不成立 |
| ②静置,向上层清液中滴加酚酞溶液。 | 溶液 | 假设二成立 |
(1)步骤①滴加过量的氯化钡溶液的目的是 ;
(2)有同学提出用氢氧化钡溶液代替氯化钡溶液做同样的实验,也能看到相同的现象,得出相同的结论。你同意他的观点吗?为什么?
, 。
【反思】氢氧化钠敞口放置变质的原因是 (用化学方程式表示),因此氢氧化钠应 保存。
【定量研究】
从该瓶中取出一定量的溶液,向其中加入含7.4g氢氧化钙的石灰水,恰好完全反应,过滤,将滤液蒸干,得到12g白色固体。则所取的溶液中含碳酸钠和氢氧化钠的质量分别是多少克?
【提出猜想】完全(或全部)
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量该溶液于试管中,向其中滴加过量的氯化钡溶液; | 生成白色沉淀 | 假设 一 不成立 |
| ②静置,向上层清液中滴加酚酞溶液。 | 溶液 变红 | 假设二成立 |
(1)除尽溶液中的碳酸钠,避免对检验氢氧化钠造成干扰;
(2)不同意,因为加入氢氧化钡溶液引入了OH—,对检验氢氧化钠会造成干扰。
【反思】2NaOH+CO2==Na2CO3+H2O(2分)、密封。
【定量研究】所取的溶液中含碳酸钠10.6g,氢氧化钠4g。
试题分析:根据题意:
【提出猜想】假设三:该溶液完全(或全部)变质。
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量该溶液于试管中,向其中滴加过量的氯化钡溶液; | 生成白色沉淀 | 假设一不成立 |
| ②静置,向上层清液中滴加酚酞溶液。 | 溶液变红色 | 假设二成立 |
(1)步骤①滴加过量的氯化钡溶液的目的是除尽溶液中的碳酸钠,避免对检验氢氧化钠造成干扰;
(2)本题不能用氢氧化钡溶液代替氯化钡溶液做同样的实验,因为加入氢氧化钡溶液引入了OH—,对检验氢氧化钠会造成干扰。故不能同意该同学的意见。
【反思】氢氧化钠敞口放置变质的原因是2NaOH+CO2==Na2CO3+H2O,因此氢氧化钠应密封保存。
【定量研究】
解:设所取的溶液中含碳酸钠的质量为x,反应生成氢氧化钠的质量为y
Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
106 74 80
x 7.4g y
106 / x =" 74/" 7.4g =" 80" / y
x="10.6g"
y=8g
所取溶液中含氢氧化钠的质量为:12g-8g=4g
答:所取的溶液中含碳酸钠10.6g,氢氧化钠4g。
点评:本题综合性较强,难度较大,题中涉及物质鉴别问题,鉴别物质时,要根据特有的实验现象来区分和辨别,实验过程中要考虑到后续实验,不能造成干扰。而根据化学方程式计算,则要注意解题步骤,即设、写、找、列、解、答。

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目





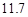 g NaCl和
g NaCl和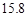 g NH4HCO3,理论上从溶液中析出晶体的质量为 g。
g NH4HCO3,理论上从溶液中析出晶体的质量为 g。