题目内容
【题目】用如图所示装置模拟废液(含FeSO4、MgSO4及一些不溶物)净化实验,步骤如下:
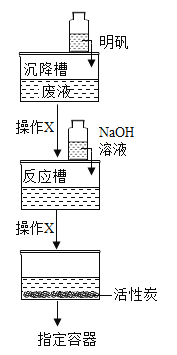
I .往沉降槽中加入适量明矾;
Ⅱ.往反应槽中缓慢加入一定浓度的NaOH溶液至沉淀完全;
Ⅲ.通过盛装有活性炭的水槽后,调节溶液的pH=7 ,存在指定容器中。
(1)明矾的作用是_________________;操作X可使固体与液体分离,操作X的名称是______________。
(2)反应槽中生成沉淀的化学方程式为________________(写一个即可)。
【答案】吸附沉降 过滤 ![]() [或
[或![]() ]
]
【解析】
(1)明矾是一种常用的絮凝剂,其作用是吸附杂质,加速杂质沉降;操作X可使固体与液体分离,操作X是过滤;
(2)在反应槽中生成沉淀的反应有两个:①硫酸镁和氢氧化钠反应生成氢氧化镁沉淀和硫酸钠,化学方程式为:![]() ;②硫酸亚铁和氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠,化学方程式为:
;②硫酸亚铁和氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠,化学方程式为:![]() 。
。

【题目】根据下表回答问题
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g水) | NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 |
NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)40℃时,100g水中最多溶解NH4Cl______g。
(2)若要从60℃时的饱和NaCl溶液中得到NaCl晶体,采用的方法是_______________。
(3)A是80℃含有120g水的KNO3溶液,经过如下操作,得到102gKNO3固体。
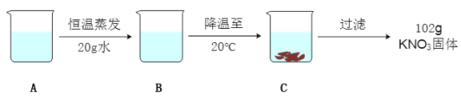
①A溶液为__________(填“饱和”或“不饱和”)溶液。
②对以下过程的分析,正确的是______(填编号)。
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.A溶液的质量等222g
d.开始析出KNO3固体的温度在60℃至80℃之间
【题目】实验室常用石灰石和稀盐酸制取二氧化碳.
探究一 气体发生装置的选择
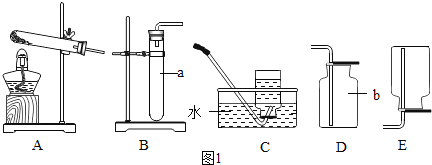
(1)写出图1中带标号仪器的名称:a__;b__.
(2)实验室制取二氧化碳气体,发生和收集装置分别选用__ 和__ (填字母),检验集满的方法是__.
探究二 药品的选择
小明对三组药品进行了研究,实验记录如下:
组别 | 药品 | 实验现象 |
① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 粉末状石灰石和稀盐酸 | 产生气泡速率很快 |
对照实验①③,是探究__对产生二氧化碳速率的影响;
对照实验__,是探究不同的酸对产生二氧化碳速率的影响;
小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为;__
探究三 生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量
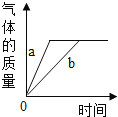
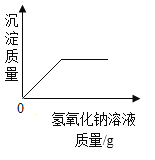
途径一(如图2):由图可知产生二氧化碳的质量为__g.
途径二(如图3):通过排水法测得生成二氧化碳的体积.
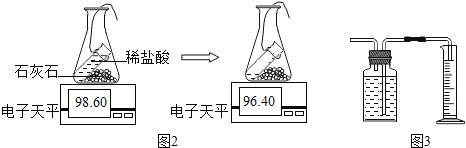
由上两种途径比较,你认为哪种途径实验结果更为准确,理由是__.
【题目】化学兴趣小组在实验室发现一瓶氢氧化钠溶液,瓶口有少量白色固体且玻璃瓶塞打不开,这一情况激起了他们浓厚的兴趣,于是展开了如下探究:
[提出问题]瓶口白色固体的成分是什么?
[查找资料]①玻璃中含有二氧化硅(SiO2),试剂瓶身经抛光处理,不易反应,而瓶口和玻璃塞上的磨砂将二氧化硅裸露出来;
②二氧化硅能与氢氧化钠溶液反应, ![]() ;
;
③硅酸钠(Na2SiO3)是种白色固体,有很强的粘合性,可溶于水,溶液呈碱性;硅酸钠溶液能与强酸反应,如:![]() ;硅酸钠溶液能与氯化钙溶液反应:
;硅酸钠溶液能与氯化钙溶液反应:![]() 。
。
[作出猜想]白色固体的成分是:Ⅰ.硅酸钠; Ⅱ.硅酸钠和碳酸钠; Ⅲ.硅酸钠、碳酸钠和氢氧化钠
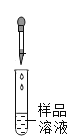
[实验探究]取一定量白色固体溶于适量水中形成样品溶液,分组进行如下实验并相互评价:
实验操作 | 实验现象 | 结论与评价 | ||
第 1 组 |
滴加足量_______ | 有气泡冒出,且产生白色沉淀 | 同学们认为猜想I______(成立或不成立);写出生成气体的化学方程式_______ | |
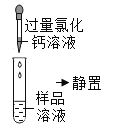
第 2 组 | 第一步 |
| 产生白色沉淀 | 第1组同学认为:此步骤还不能准确判断出原固体的成分 |
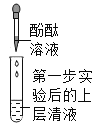
第二步 |
| ________ | 大家一致认为:猜想Ⅱ成立 | |
[反思交流]
(1)第2组实验第一步中加入过量氯化钙的作用是____________________________。
(2)有同学认为,第2组实验中不能用氢氧化钙溶液代替氯化钙落液,理由是______________________。
(3)氢氧化钠溶液必须密封保存,且试剂瓶只能用_____________塞。