题目内容
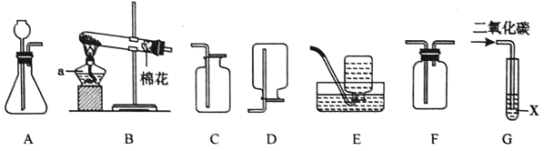
【题目】以下是实验室制取气体的常用仪器,回答下列问题。

(1)标号为E的仪器名称是_____;
(2)用2KMnO4![]() K2MnO4+MnO2+O2↑制取O2,并用向上排空气法收集。
K2MnO4+MnO2+O2↑制取O2,并用向上排空气法收集。
①若制取3.2gO2,理论上至少需要KMnO4_____g。
②检验O2收集满的方法是_____;
(3)用大理石和稀盐酸反应制取CO2,并用排水法收集,则组装制取装置时,需选择如图的A、C、G、H、L、N、O和_____。
【答案】铁架台 31.6 将带火星的木条放在集气瓶口,若木条复燃,证明氧气已满 M 。
【解析】
(1)标号为E的仪器名称是铁架台;
(2)①设需要高锰酸钾的质量为x,则:
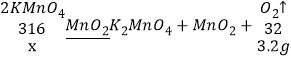
![]()
x=31.6g
答:需要高锰酸钾的质量为31.6g。
②氧气具有助燃性,验满时将带火星的木条放在集气瓶口,若木条复燃,证明氧气已满;(3)用大理石和稀盐酸反应制取CO2,属于固液常温型,用排水法收集需要用仪器A、C、G、H、L、N、O和M来组装。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】菱镁矿的主要成分是MgCO3,为了分析某菱镁矿中MgCO3的含量,学习小组进行了实验研究.取10克菱镁矿样品,向其中逐滴加入未知质量分数的H2SO4溶液,生成的气体全部用NaOH溶液吸收,NaOH溶液增加的质量记录如表:
加入H2SO4溶液的质量/g | 50 | 100 | 150 | 200 |
NaOH溶液增加的质量/g | 2.2 | 4.4 | 4.4 | 4.4 |
(假设菱镁矿中的杂质不溶于水,不与酸发生反应.)
(1)10克菱镁矿与H2SO4溶液完全反应,生成CO2的质量为_____.
(2)该菱镁矿中MgCO3的质量分数是多少?____
(3)该实验研究中所用H2SO4溶液的溶质质量分数是多少?____