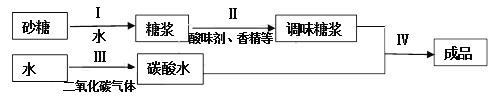
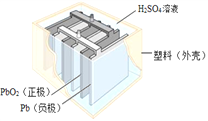
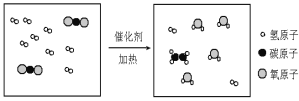
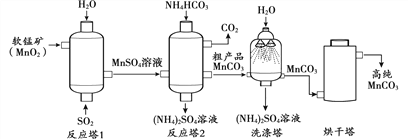
题目内容
【题目】高纯铊(Tl)及其合金可做半导体材料。已知硫酸亚铊(T12SO4)溶液为无色,氢氧化亚铊(T1OH)溶液显黄色;用硫酸亚铊溶液可制得氢氧化亚铊,氢氧化亚铊加热分解生成氧化亚铊(T12O)和水,氧化亚铊与氢气加热得到铊。
(1)铊元素的化合价有+1、+3价,写出氧化铊的化学式_________________。
(2)取少量无色硫酸亚铊溶液于试管中,再滴加适量氢氧化钡溶液,充分振荡、静置,观察到的实验现象是_________,反应的化学方程式为________________。
(3)氢氧化亚铊加热分解的化学方程式为________________。
(4)氧化亚铊与氢气加热生成铊和水,该反应属属于______________(填反应类型)。
【答案】 Tl2O3 有白色沉淀生成,溶液由无色变成黄色 Tl2SO4 + Ba(OH)2 == BaSO4↓ + 2TlOH 2TlOH ![]() Tl2O + H2O 置换反应
Tl2O + H2O 置换反应
【解析】(1)氧化铊中铊元素的化合价为+3,所以化学式为Tl2O3;
(2)硫酸亚铊能与氢氧化钡反应生成硫酸钡沉淀和氢氧化亚铊,化学方程式为:Tl2SO4+Ba(OH)2═BaSO4↓+2TlOH;故会观察到有白色沉淀生成,溶液由无色变成黄色;
(3)氢氧化亚铊受热分解生成氧化亚铊和水,化学方程式为:2TlOH ![]() Tl2O+H2O;
Tl2O+H2O;
(4)氧化亚铊与氢气加热生成铊和水,是一种单质和一种化合物反应生成另一种单质和另一种化合物的化学反应,属于置换反应。

【题目】(1)下列“化学之最”正确的是(________)
A.人体内含量最多的金属元素是钙 B.地壳中体积分数最高的元素是氧
C.导电性最好的金属是银 D.硬度最大的金属是金刚石
E.有机物中质量分数最高的元素是碳
(2)从下列两题中任选一题作答:
甲——铁丝在氧气中的燃烧 | 乙——硫在氧气中燃烧 |
Ⅰ.集气瓶中放水的作用是_________。 Ⅱ.现象_________。 Ⅲ.反应的方程式_________。 | Ⅰ.集气瓶中放水的作用是_________。 Ⅱ.现象_________。 Ⅲ.反应的方程式_________。 |
【题目】为探究影响氯酸钾分解速率的因素,小红同学把实验温度恒定在330℃或380℃,(其他实验条件见下表),并设计了以下实验。
实验编号 | 氯酸钾的质量 | 其他物质的质量∕g | 温度∕℃ | 收集氧气的体积/mL | 反应所需时间∕s |
① | 2.0 | 330 | 100 | t1 | |
② | 2.0 | CuO 0.5 | 330 | 100 | t2 |
③ | 2.0 | MnO2 0.5 | 330 | 100 | t3 |
④ | 2.0 | MnO2 ____ | _______ | 100 | t4 |
请回答
(1)进行实验②和③,并对对比,其实验目的是____________________。
(2)要说明氧化铜对氯酸钾分解速率的影响,则要选用实验______和实验_______进行对比。
(3)用实验③和④探究温度对氯酸钾分解速率的影响,则MnO2的质量是__________g,反应的温度是_________℃,实验④发生反应的化学方程式为___________________;若t3>t4,氯酸钾分解速率与温度的关系是__________________。