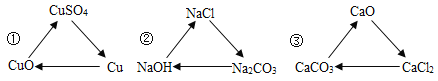
题目内容
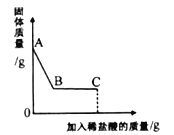
【题目】天平两端的烧杯中分别放有足量的等质量、等溶质质量分数的稀盐酸,调整天平到平衡后,向天平右边烧杯中加入2.8gCaO,若仍使天平最终保持平衡,应向左端的烧杯中加入碳酸钙的质量是
A. 2.8g B. 5g C. 3g D. 3.2g
【答案】B
【解析】根据题意可知天平右边加入氧化钙,充分反应后总质量反应前后没变,相对于稀盐酸来说,溶液质量增加了2.2g,所以要保持天平平衡,必须使左边加入碳酸钙后,溶液质量增加也必须为2.2g。因为碳酸钙加入后和盐酸反应,放出气体,所以选项A一定不正确。所以只需要对选项BCD其中一个进行计算验证即可。
CaCO3+2HCl═CaCl2+ H2O+CO2↑ 溶液质量增加
100g 44g 24g
![]() g 2.2g
g 2.2g
![]()
![]() =5g。故选B。
=5g。故选B。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
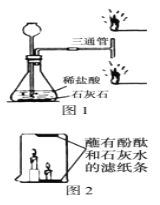
芒果教辅暑假天地重庆出版社系列答案【题目】在研究酸和碱的化学性质时,某小组想证明稀硫酸与氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应,试与他们一起完成实验方案的设计,实施和评价,并得出有关结论.
(设计实验)
(1)探究稀硫酸与氢氧化钠溶液的反应:
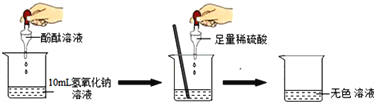
当滴入几滴酚酞试液后,溶液由无色变为________色,根据上述实验中颜色变化,可确定稀硫酸与氢氧化钠溶液发生了化学变化,反应的化学方程式为:_____________________.
(2)探究上述稀硫酸与氢氧化钠溶液反应后烧杯中的硫酸是否过量:
根据上述反应过程中溶液变成无色,不能确定稀硫酸是否过量,同学们又分别选取氯化钡溶液、紫色石蕊试液设计实验方案,请你判断并分析:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀硫酸过量 |
方案二 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 稀硫酸过量 |
上述设计的实验方案中,正确的是__________(填“方案一”或“方案二”)另外一个实验方案错误的原因是________________________;
(实验延伸)请你设计一个确定稀硫酸是否过量的实验方案,你选用的药品是____________,实验现象及结论是________________________.
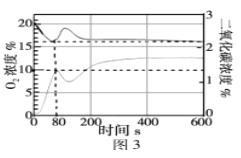
(交流与反思)下图是小明和老师一起向氢氧化钠溶液中逐渐滴入稀硫酸时用数字化实验测定的反应溶液温度和pH的变化曲线。请你思考:
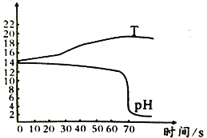
(1)为什么在0-60秒pH变化不大?_____________________;
(2)请仔细观察图2,从中获得的一条信息是_____________________。