题目内容
【题目】氧化亚铜(Cu2O)用途广泛,实验室以CuSO4为原料制备Cu2O步骤如下:
预热:分别预热CuSO4溶液和Na2SO3溶液。
反应:在玻璃反应器中混合上述两种溶液,热水浴,搅拌,同时控制反应液pH。
处理:自然冷却后过滤,用蒸馏水洗涤4~5次,在80℃真空干燥箱中烘干,保存产品。
已知:Cu2O在潮湿空气中会逐渐氧化成CuO。
(1)反应原理为2CuSO4+3Na2SO3![]() Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
Cu2O↓+3_+2SO2↑。实验时,热水浴加热的优点是___。
(2)实验中,反应温度、反应液pH对产物中Cu2O%的影响分别如图所示:
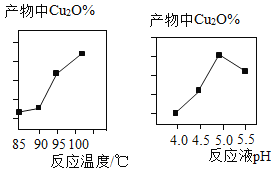
分析图像可知:最佳反应温度为____℃,该反应温度的优点有①____、②____。最佳反应液pH为_,若pH过低,产物中会有Cu杂质,则产物中Cu元素的质量分数将__(填“偏大”或“偏小”或“不变”)。
(3)产品洗净的标准是:取最后一次洗涤液,加入____(填试剂名称)溶液,若无白色沉淀产生,则说明已经洗净。
(4)产品烘干及保存要避免和潮湿空气接触,原因是____(填化学方程式)。
(5)工业上用CuSO4·5H2O制备Cu2O,若得到14.40吨Cu2O和一定质量的CuO(假设生产过程中Cu元素无损失),其中Cu2O和CuO的质量比为12:1,计算需要CuSO4·5H2O多少吨?写出计算过程,精确到小数点后两位)____
【答案】Na2SO4 受热均匀,容易控制温度 100 产物中氧化亚铜的含量最大 反应速度快 5.0 偏大 氯化钡 2Cu2O+O2=4CuO 53.75吨。
【解析】
(1)反应前铜、硫、钠、氧原子个数依次为2、5、6、17;反应后铜、硫、钠、氧原子个数依次为2、2、0、5;反应原理为2CuSO4+3Na2SO3![]() Cu2O↓+3 Na2SO4+2SO2↑。实验时,热水浴加热的优点是:受热均匀,容易控制温度。
Cu2O↓+3 Na2SO4+2SO2↑。实验时,热水浴加热的优点是:受热均匀,容易控制温度。
(2)
分析图像可知:最佳反应温度为100℃,该反应温度的优点有①产物中氧化亚铜的含量最大、②反应速度快。pH为5.0时,产物中氧化亚铜的含量最大,最佳反应液pH为5.0,若pH过低,产物中会有Cu杂质,铜是单质,只含有铜元素,则产物中Cu元素的质量分数将偏大。
(3)氯化钡和硫酸钠反应生成硫酸钡和氯化钠。产品洗净的标准是:取最后一次洗涤液,加入氯化钡溶液,若无白色沉淀产生,则说明没有硫酸钠,已经洗净。
(4)产品烘干及保存要避免和潮湿空气接触,原因是氧化亚铜和氧气反应生成氧化铜,化学方程式为2Cu2O+O2=4CuO。
(5)
设氧化铜的质量为x,
14.40吨:x=12:1,x=1.2吨,
![]() ,
,![]()
12.8吨+0.96吨=13.76吨
CuSO4·5H2O中铜元素的质量分数为![]()
13.76吨÷25.6%=53.75吨。

 阅读快车系列答案
阅读快车系列答案