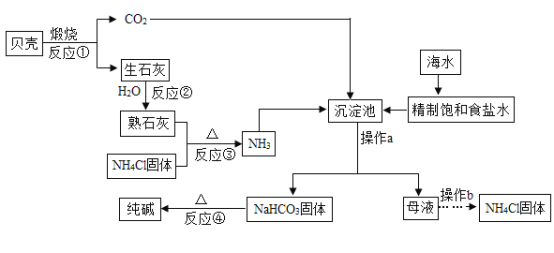
题目内容
【题目】控制变量设计对比实验是实验探究的重要方法,请参与下列探究并回答问题:
实验一:探究影响过氧化氢溶液分解速率的因素

A B
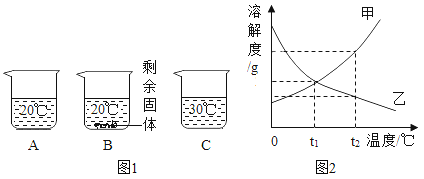
同时打开A和B装置中分液漏斗的旋塞,根据锥形瓶内产生气泡的速率,得出_________会影响过氧化氢溶液的分解速率,为准确直观比较分解速率的快慢,可测定相同时间内收集到的氧气体积,或者测定_________。
实验二:探究金属与盐溶液的反应
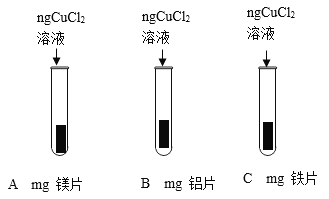
将打磨过的镁片、铝片、铁片分别与氯化铜溶液反应,观察到金属表面都有红色物质生成且镁片、铝片表面还有气泡产生,且产生气泡的速率镁比铝快,铁片表面几乎看不到气泡产生经查阅资料知氯化铜溶液呈酸性。请写出B试管内发生反应的化学方程式__________________;由此实验______________(填能或否)得出镁铝铁铜四种金属的活动性顺序。
实验三:探究二氧化碳能否与碱溶液反应
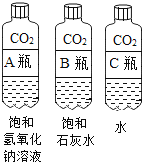
①对比 A 瓶与 B 瓶的实验现象,请说明实验室用氢氧化钠溶液吸收CO2,用石灰水检验二氧化碳的理由_________;
②A瓶与 B瓶的对比,因为 A瓶严重变瘪,说明_________消失,可证明二氧化碳与氢氧化钠溶液发生了反应,也可以通过加入下列物质中的_________证明新物质的生成,从而说明反应的发生。
A 酚酞试液 B 稀盐酸 C Ca(OH)2溶液 D CaCl2溶液
【答案】过氧化氢溶液的浓度 收集到相同体积气体所需的时间 2Al+3CuCl2=2AlCl3+3Cu;2Al+6HCl=2AlCl3+3H2↑ 能 氢氧化钠易溶于水,氢氧化钙微溶于水,使用氢氧化钠溶液吸收二氧化碳,更充分更彻底;二氧化碳与氢氧化钠溶液反应无明显现象,与氢氧化钙溶液反应,产生白色沉淀,使用氢氧化钙溶液检验二氧化碳,现象明显,更易判断 二氧化碳气体 BCD
【解析】
实验一:由题目的信息可知,同时打开A和B装置中分液漏斗的旋塞,观察锥形瓶中反应情况,装置B中的气泡比A多,过氧化氢溶液的浓度会影响过氧化氢的分解速率;测定相同时间内收集到的氧气体积,或者测定收集到相同体积气体所需的时间都可准确直观比较分解速率的快慢。故填:过氧化氢溶液的浓度;收集到相同体积气体所需的时间。
实验二:铝的活泼性比铜强,所以铝可以和氯化铜反应生成铜和氯化铝,反应的方程式为:2Al+3CuCl2=2AlCl3+3Cu;又因氯化铜溶液呈酸性,且观察到铝片表面还有气泡产生,所以铝还和里面的盐酸反应生成了氯化铝和氢气,反应的化学方程式为:2Al+6HCl=2AlCl3+3H2↑;A、B、C中均有红色物质生成,说明镁、铝、铁都能和氯化铜发生反应将铜置换出来,即镁、铝、铁的活泼性都强于铜,又因镁片、铝片表面还有气泡产生,且产生气泡的速率镁比铝快,铁片表面几乎看不到气泡,证明镁的活泼性强于铝,铝的活泼性强于铁,所以此实验能证明出来镁铝铁铜四种金属的活动性顺序。故填:2Al+3CuCl2=2AlCl3+3Cu、2Al+6HCl=2AlCl3+3H2↑;能。
实验三:①A瓶中瓶子变瘪的程度最大,B瓶中变瘪的程度比A小,且里面溶液变浑浊,是因为二氧化碳与石灰水反应产生白色沉淀,而二氧化碳与氢氧化钠反应没有明显的现象,因此检验二氧化碳选择石灰水;氢氧化钠易溶于水,而氢氧化钙微溶于水,因此等量的氢氧化钠溶液吸收二氧化碳比石灰水多,因此吸收二氧化碳选择氢氧化钠溶液;故填:氢氧化钠易溶于水,氢氧化钙微溶于水,使用氢氧化钠溶液吸收二氧化碳,更充分更彻底;二氧化碳与氢氧化钠溶液反应无明显现象,与氢氧化钙溶液反应,产生白色沉淀,使用氢氧化钙溶液检验二氧化碳,现象明显,更易判断。
②A瓶比B瓶变瘪严重是因为二氧化碳气体被氢氧化钠反应的多导致二氧化碳消失的多瓶内气压变小,所以瓶子会严重变瘪;二氧化碳和氢氧化钠反应生成碳酸钠和水,若加入酚酞进行检验不管氢氧化钠和二氧化碳反没反应都是会变红色,所以无法检验是否发生反应;若加入盐酸,盐酸会和碳酸钠反应有气泡生成,而和氢氧化钠反应无明显现象,这时只要有气泡生成就能证明氢氧化钠和二氧化碳反生了反应;若加入氢氧化钙,氢氧化钙会和碳酸钠反应生成白色沉淀,而不和氢氧化钠反应,这时只要有白色沉淀生成就能证明氢氧化钠和二氧化碳反生了反应;若加入氯化钙,氯化钙会和碳酸钠反应生成白色沉淀,而不和氢氧化钠反应,这时只要有白色沉淀生成就能证明氢氧化钠和二氧化碳反生了反应;故填:二氧化碳气体;BCD。

【题目】化学就在我们身边,请用所学的化学知识填空。
(1)从H、O、C、Cl、Ca五种元素中,选择适当的元素组成符合下列要求的物质,并用化学式填空(每空只填一种物质)。
①相对分子质量最小的氧化物是_______;
②农业上用来降低土壤酸性的_________;
③可用于金属表面除锈的是____________;
④厨房用的酸性调味品是____________;
⑤最简单的有机物是________。
(2)以下是日常生活中常用各种清洗剂
名称 | 洗涤灵 | 洁厕灵 | 炉具清洁剂 | 活氧彩漂 | 污渍爆炸盐 |
产品样式 |
|
|
|
|
|
有效成分或功能 | 清洗油污 | 盐酸 | 氢氧化钠 | 过氧化氢 | 过碳酸钠 |
①使用洗涤灵清洗餐具上的油污,这是因为它具有__________功能。
②清除以下物质,可使用炉具清洁剂的是______________(填字母序号)。
a.铁锈 b.油污 c.水垢
③“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,再加入足量的洁厕灵,产生能使澄清石灰水变浑浊的气体,此反应体现了如图中______________(选填①②③④)性质关系。

④将洁厕灵加入滴有酚酞的炉具清洁剂中,若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)_____________________。