题目内容
【题目】四个烧杯中分别盛有饱和澄清石灰水、稀盐酸、氯化钠溶液、碳酸钠溶液中的一种,向其中分别滴加无色酚酞溶液或紫色石蕊溶液后四个烧杯中液体的颜色如图所示。则A溶液是( )
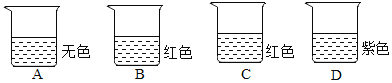
A. 澄清石灰水 B. 稀盐酸 C. 氯化钠溶液 D. 碳酸钠溶液
【答案】B
【解析】澄清石灰水、碳酸钠溶液均显碱性,稀盐酸显酸性,氯化钠溶液显中性;紫色石蕊溶液遇酸性溶液变红、遇碱性溶液变蓝、遇中性溶液不变色,则D溶液中的指示剂只能是紫色石蕊溶液,且D溶液是呈中性的氯化钠溶液;无色酚酞溶液遇碱性溶液变红,遇酸性溶液和中性溶液不变色;可推断出A中的指示剂只能是无色酚酞溶液,且A溶液是显酸性的盐酸;B与C分别是澄清石灰水和碳酸钠溶液中的一种,由于二者都能使无色酚酞溶液变成红色,可推断出B、C中滴入的指示剂是无色酚酞溶液,但无法判断B、C的成分。

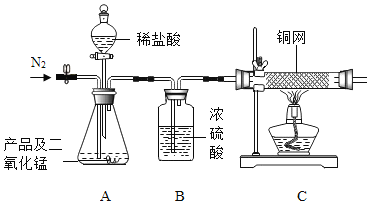
【题目】化学兴趣小组在实验室用氯酸钾和二氧化锰混合加热制取氧气,该反应的化学表达式为________。某次实验时偶然发现制得的气体有刺激性气味,这一现象引起了同学们的兴趣,于是在老师的指导下对该气体成分进行探究。
【提出问题】氯酸钾与二氧化锰混合加热后产生的气体成分是什么?
【查阅资料】
①氯酸钾与二氧化锰混合加热产生的气体只以单质形式存在;
②氯气(Cl2)是有刺激性气味的气体,能溶于水,能使湿润的淀粉碘化钾试纸变蓝。
【猜想假设】
猜想一:该气体为O2;猜想二:该气体为______;猜想三:该气体为O2和Cl2的混合物。
【实验探究】
序号 | 操作 | 现象 | 结论 |
方案Ⅰ | 用排水集气法收集甲、乙两瓶气体,将带火星的木条伸入甲瓶,湿润的淀粉碘化钾试纸伸入乙瓶。 | 木条复燃, 淀粉碘化钾试纸不变色 | 猜想_______成立 |
方案Ⅱ | 向上排空气法收集甲、乙两瓶气体,将带火星的木条伸入甲瓶,湿润的淀粉碘化钾试纸伸入乙瓶。 | 木条______, 淀粉碘化钾试纸为___色 | 猜想三成立 |
【反思评价】
为什么两种方案得出的结论不一致?哪个是正确的?
①同学:方案Ⅰ结论不正确,其操作不合理,不合理之处是__________。
②老师:不需要进行实验,就能排除猜想一,理由是__________。
【拓展应用】
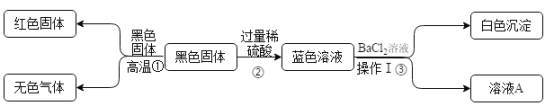
实验结束后,该组同学准备回收固体剩余物中的不溶物二氧化锰,实验的主要步骤为:①溶解、②________、③洗涤干燥。步骤②中玻璃棒的作用是_________。