题目内容
【题目】硫酸工业产生的废气 A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气 A 的组成进行探究,请回答下列问题:
(1)甲同学设计实验检验废气 A 中含有CO2,应选择的试剂有_______.
A NaOH 溶液 B 酸性KMnO4溶液 C 澄清石灰水 D 盐酸
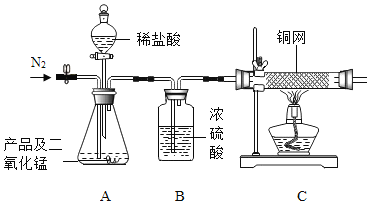
(2)乙同学欲测定废气 A 中SO2的含量,取 a L 废气 A 并设计了如下装置进行实验.
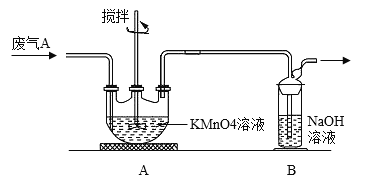
①为了保证实验成功,装置 A 应具有的现象是______。搅拌的目的是______。
②丙同学认为 A 装置前后的质量差就是 a L 废气中含有的SO2的质量,然后进行含量计算。丁同学提出质疑,若按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,丁同学推断的理由是 ____。
【答案】BC 溶液未完全褪色 提高SO2的吸收率 生成的亚硫酸被气体中氧气氧化
【解析】
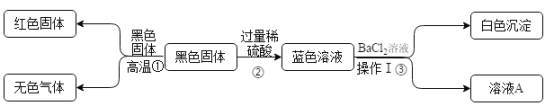
设计实验检验废气A中含有的CO2,需要除去二氧化硫,避免干扰二氧化碳的检验,除净二氧化硫的气体通过澄清石灰水检验二氧化碳的存在;测定废气A中SO2的含量,为了保证实验成功需要在A装置中用高锰酸钾溶液全部吸收,高锰酸钾溶液不褪色证明吸收完全,搅拌的主要作用是充分吸收二氧化硫,提高吸收率;测定的结果偏大,可能是生成的亚硫酸被气体中氧气氧化,气体质量增大。
(1)硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境,设计实验检验废气A中含有的CO2,需要除去二氧化硫,避免干扰二氧化碳的检验,除净二氧化硫的气体通过澄清石灰水检验二氧化碳的存在,石灰水变浑浊证明含有二氧化碳,所以需要高锰酸钾溶液和澄清石灰水,故选BC。
(2)①为了保证实验成功需要在A装置中用高锰酸钾溶液全部吸收二氧化硫,高锰酸钾溶液不完全褪色证明二氧化硫吸收完全,故装置A 应具有的现象是溶液未完全褪色。搅拌的主要作用是充分吸收二氧化硫,提高吸收率,故搅拌的目的是提高SO2的吸收率。
②二氧化碳和水反应生成亚硫酸,亚硫酸被气体中氧气氧化,废气中SO2完全被吸收,测定的结果偏大,故丁同学推断的理由是生成的亚硫酸被气体中氧气氧化。

【题目】乙醇(C2H6O)在一定量的氧气中不完全燃烧时可以产生二氧化碳、水和物质X。
物质 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 58 | 89.6 | 0 | 15 | 0 |
反应后质量/g | 12 | 0 | 70.4 | 69 | a |
(1)根据表中数据分析,a的值为______
(2)X的化学式为____
(3)写出本题中乙醇燃烧的化学方程式:________