题目内容
【题目】实验室有一瓶长期露置于空气中的氢氧化钠溶液,确认已变质.某学习小组展开如下探究,确定该溶液的成分,并进一步从变质的溶液中回收氢氧化钠.
【问题1】久置的氢氧化钠溶液是全部变质?还是部分变质?
【探究1】确定该溶液中溶质的成分.
实验操作 | 实验现象 | 实验结论 |
(1)取少量溶液于试管中,向溶液中滴加过量__________ 溶液,并不断振荡.方程式为______________________。 | 白色沉淀产生 | 该溶液部分变质,含有 碳酸钠和氢氧化钠. |
(2)将步骤(1)反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液. | __________ |
【反思】氢氧化钠溶液变质的原因___________________(用化学方程式表示),因此氢氧化钠溶液必须密封保存.
【问题2】如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体.
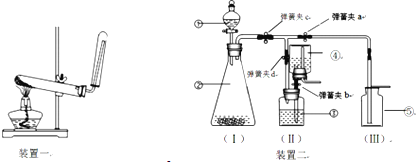
【探究2】回收纯净的氢氧化钠固体.(已知:氢氧化钠溶解度随温度升高增大明显)
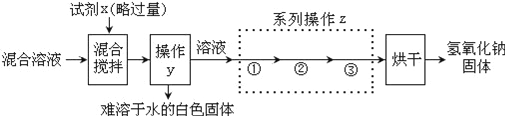
请回答下列问题:
(3)试剂X是________________,反应的方程式___________________________________。
(4)系列操作z中步骤②的名称是________________,它与操作y是相同的。
(5)探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,请说明本质的不同是什么 _____________________________________.
【答案】 氯化钙(CaCl2) CaCl2+ Na2 CO3 == Ca CO3↓ + 2 NaCl 变红 2NaOH+ CO2 == Na2 CO3 + H2O 石灰水(或 Ca(OH)2 ) Ca(OH)2 + Na2 CO3 == Ca CO3↓ + 2NaOH 过滤 前者是检验并除去碳酸钠,以免干扰氢氧化钠的检验,后者是除杂碳酸钠,使反应生成氢氧化钠
【解析】【探究1】 (1)氢氧化钠在空气中放置时易于空气二氧化碳反应变质生成碳酸钠和水,碳酸钠能与氯化钙或氯化钡反应生成碳酸钙(或碳酸钡白色沉淀),取少量溶液于试管中,向溶液中滴加过量氯化钙或氯化钡溶液,通过有白色沉淀生成可证明有碳酸钠(即氢氧化钠变质),同时还可以除掉碳酸钠,然后向反应所得溶液中加入酚酞试液,溶液变红,证明还有氢氧化钠,【反思】氢氧化钠溶液变质的化学方程式为: 2NaOH+CO2===Na2CO3+H2O ,因此氢氧化钠溶液必须密封保存.【探究2】(3)碳酸钠和氢氧化钙反应生成碳酸钙和氢氧化钠,也能与氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,试剂X是氢氧化钙或氢氧化钡,反应的方程式Na2CO3 +Ca(OH)2=CaCO3↓+2NaOH。(4) 操作y是将难溶固体与液体分离,是过滤操作,系列操作z与操作y,所以也是过滤。(5)探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,前者是检验并除去碳酸钠,以免干扰氢氧化钠的检验,后者是除杂碳酸钠,使反应生成氢氧化钠。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案