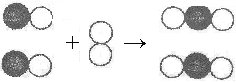题目内容
【题目】实验室制备气体可采用不同的装置
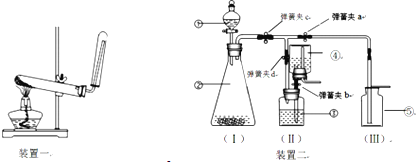
(1)若用装置一制取和收集某气体,由此可推知_______(填序号)
①反应物都是固体 ②反应需要催化剂
③气体密度比空气小 ④可用于制取和收集氧气
装置中不属于玻璃仪器的是__________ ;
(2)宏志班某化学兴趣小组为探究O2的性质,需制取几瓶干燥或纯净的O2,他们对装置一进行改进,设计了装置二。反应开始,用⑤收集第一瓶O2时,需打开弹簧夹a、c,关闭弹簧夹b、d;用 ③收集第二瓶O2时需_________(填序号),……
A.打开弹簧夹c、d,关闭弹簧夹a、b B.打开弹簧夹b、d,关闭弹簧夹a、c
C.打开弹簧夹a、b、d,关闭弹簧夹c D.打开弹簧夹b、c、d,关闭弹簧夹a
(3)实验室用装置二制取和收集两瓶CO2,②中发生反应的化学方程式: _____________________,用③集气时,瓶中液体应具备的性质是________________________;
(4)实验室用锌粒和稀硫酸反应制取H2。打开弹簧夹a、b、d,关闭弹簧夹c,用装置二(II)、(III)来完成,收集时应对装置(III)作的改进是:将____________________;
(5)比较装置一,装置二的优点有__________________(填序号)
①便于制取较大量的气体 ②便于控制反应的速率 ③便于储存气体,随取随用
④便于控制反应随时发生,随时停止 ⑤收集多瓶气体时可减少气体的逸散
【答案】 ①③ 铁架台 D 略 不溶解CO2,且不与CO2反应 将⑤倒立 ①②③⑤
【解析】(1)装置一适用于加热固体制取气体,收集试管口向下,说明气体的密度比空气小。装置中不属于玻璃仪器的是铁架台;(2)用 ③收集第二瓶O2时需打开弹簧夹d、c,关闭弹簧夹a使气体进入集气瓶内,打开b使集气瓶中的水被排出;(3)实验室用石灰石和稀盐酸制取CO2,②中发生反应的化学方程式CaCO3 + 2HCl == CaCl2 + H2O + CO2↑,用③集气时,瓶中液体应具备的性质是不溶解CO2,且不与CO2反应 ;(4)实验室用锌粒和稀硫酸反应制取H2。打开弹簧夹a、b、d,关闭弹簧夹c,用装置二(II)、(III)来完成,收集时应对装置(III)作的改进是:由于氢气的密度比空气小。应将⑤倒立;(5)比较装置一,装置二的优点①发生装置容积大,能盛放的药品多,便于制取较大量的气体 ②装置二使用了分液漏斗,可以控制液体的滴加速率,而便于控制反应的速率 ③从d输入气体时能完成气体的收集,从另一端输入液体时,气体可以从集气瓶中排出,因此便于储存气体,随取随用;④因无法控制反应物之间是否接触,因而不能控制反应随时发生,随时停止 ; ⑤弹簧夹abcd可以随时关闭或打开,所以收集多瓶气体时可减少气体的逸散。

 举一反三单元同步过关卷系列答案
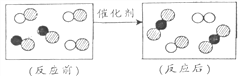
举一反三单元同步过关卷系列答案【题目】实验室有一瓶长期露置于空气中的氢氧化钠溶液,确认已变质.某学习小组展开如下探究,确定该溶液的成分,并进一步从变质的溶液中回收氢氧化钠.
【问题1】久置的氢氧化钠溶液是全部变质?还是部分变质?
【探究1】确定该溶液中溶质的成分.
实验操作 | 实验现象 | 实验结论 |
(1)取少量溶液于试管中,向溶液中滴加过量__________ 溶液,并不断振荡.方程式为______________________。 | 白色沉淀产生 | 该溶液部分变质,含有 碳酸钠和氢氧化钠. |
(2)将步骤(1)反应后的混合物静置,取少量上层清液,滴加2~3滴酚酞试液. | __________ |
【反思】氢氧化钠溶液变质的原因___________________(用化学方程式表示),因此氢氧化钠溶液必须密封保存.
【问题2】如何从变质的氢氧化钠溶液中回收得到较纯净的氢氧化钠固体.
【探究2】回收纯净的氢氧化钠固体.(已知:氢氧化钠溶解度随温度升高增大明显)
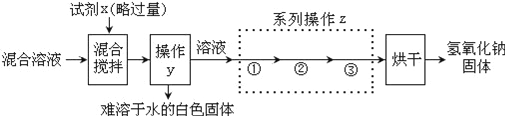
请回答下列问题:
(3)试剂X是________________,反应的方程式___________________________________。
(4)系列操作z中步骤②的名称是________________,它与操作y是相同的。
(5)探究1中的物质检验和探究2中的除杂提纯都将碳酸钠进行了转化,但二者目的不同,请说明本质的不同是什么 _____________________________________.