题目内容
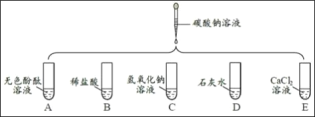
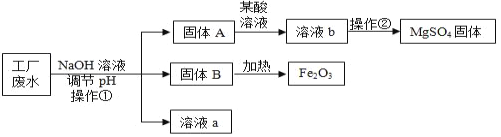
【题目】某工厂的废水中含有MgSO4和FeCl3等,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
资料:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Mg(OH)2 |
开始沉淀 | 1.9 | 9.1 |
完全沉淀 | 3.2 | 11.1 |
(1)操作①的名称__________,该工厂废水一定呈__________性。
(2)用NaOH溶液调节溶液的pH,pH的控制在__________范围内,可使废液中的铁离子(Fe3+)完全沉淀,而镁离子(Mg2+)又不损耗。
(3)操作②时,当__________即可停止加热。
(4)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为_____。
(5)溶液a除了可能含有NaOH外,还一定含有的溶质是________(填化学式)。
(6)配制2000kg质量分数为5%的氢氧化钠溶液,需要氢氧化钠______Kg。
【答案】过滤 酸 3.2≤pH<9.1 析出大量晶体 H2O NaCl、Na2SO4 100
【解析】
(1)由图可知,操作①是将固体与溶液分离,故操作名称为:过滤,填写:过滤;
由表格可知,Fe(OH)3开始沉淀的PH为1.9,沉淀完全的PH为3.2,故该废液一定呈酸性,填写:酸;
(2) 要使废液中的铁离子(Fe3+)完全沉淀,而镁离子(Mg2+)又不损耗,pH必须控制在Fe(OH)3完全沉淀,而Mg(OH)2还没开始沉淀时,故填写:3.2≤pH<9.1;
(3)操作②是将MgSO4溶液转化为MgSO4晶体,需要蒸发,而当出现大量晶体时即可停止加热,故填写:析出大量晶体;
(4)固体B是氢氧化铁,根据质量守恒定律,当它加热时,除了生成氧化铁外,另一个氧化物为水,故填写:水;
(5)溶液a是加入氢氧化钠溶液后形成的,溶质中除了有氢氧化钠外、还应该有生成的溶质硫酸钠和氯化钠,故填写:NaCl、Na2SO4;
(6)需要氢氧化钠的质量为:2000kg×5%=100kg,故填写:100

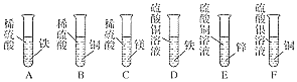
【题目】下列化学方程式书写正确的是
A. 2Fe+6HCl→2FeCl3+3H2↑B. CuSO4+2NaOH→Cu(OH)2↓+Na2SO4
C. 3Fe+2O2→Fe3O4D. H2O![]() H2↑+O2↑
H2↑+O2↑
【题目】碳酸氢钠是小苏打的主要成分,在生产和生活中有许多重要的用途。
(学生实验)化学课上,同学们为了解碳酸氢钠的性质,将一定质量的碳酸氢钠和稀硫酸混合,充分反应后,有气泡逸出,写出该反应的化学方程式:_______。同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验。
(实验用品)pH试纸、锌片、氧化铜粉末、稀硫酸、氢氧化钠溶液、氯化钡溶液。
(猜想与假设)反应后溶液中溶质的组成成分可能有哪些?
猜想一:硫酸钠;猜想二:硫酸钠、碳酸氢钠;猜想三:硫酸钠、硫酸。
(实验探究)同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成下表。
实验 方案 | A | B | C | D |
实验 操作 |
|
|
| |
实验 现象 | ________ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH______7 | |
实验 结论 | 猜想二 不正确 | 猜想三 正确 | 猜想三正确 | 猜想三 正确 |
(得出结论)猜想三正确。
(评价反思)(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予肯定,同时指出探究中存在一处明显错误操作是______________。
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由:_______________。
(总结提高)依据所给实验用品,请你设计方案D(实验操作、实验现象)确认猜想三是正确的:_______________。
【题目】根据所给的信息和标志,判断下列说法错误的是
A | B | C | D |
《淮南万毕术》中记载,曾青得铁则化为铜。 | 《梦溪笔谈》中记载,鄜、延境内有石油,旧说“高奴县出脂水”,即此也。 |
|
|
是现代湿法冶金的先驱 | 这里的石油指的是一种油脂 | 看到有该标志的丢弃物,应远离并报警 | 贴有该标志的物品是可回收物 |
A. A B. B C. C D. D