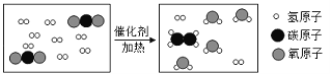
题目内容
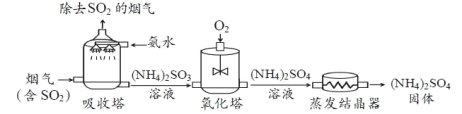
【题目】根据所学知识并结合下列仪器,回答有关问题
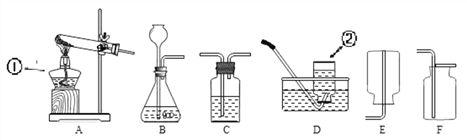
(1)写出对应仪器的名称:①_________________ ②___________________。
(2)实验室加热高锰酸钾制取并收集一瓶较纯净的氧气,应选择的装置组合是_____(填序号),该反应的化学方程式______;若收集的氧气不纯,其可能原因有________(填一种即可)。
(3)常见气体发生装置除了固体加热型和固液不加热型之外,还有固液加热型等。下图G装置是用铜和浓硫酸反应的实验装置
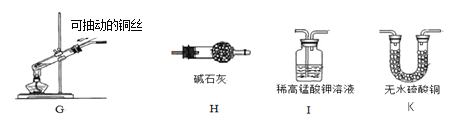
①反应原理:Cu + 2H2SO4(浓) △______+ SO2↑ + 2H2O
②G装置中将铜丝设计为可抽动,是为了控制___________________。
③生成物中的SO2是一种空气污染物,它会导致_____________(填一种空气污染名称)。
④若要验证生成物中有SO2和水蒸气,请从H、I、K中选择合适的装置序号填空:G →____→___________→尾气处理装置。
【答案】 酒精灯 集气瓶 AC 2KMnO4△K2MnO4+MnO2+O2↑ 反应前集气瓶中未装满水 CuSO4 反应的发生和停止 酸雨 K I
【解析】(1)根据常见仪器解答;(2)根据高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气解答;根据实验过程中造成误差分析解答;(3)①根据质量守恒定律分析解答;②根据可以控制反应的发生和停止解答;③根据二氧化硫能导致酸雨解答;④根据二氧化硫能使稀高锰酸钾溶液变色及水能使白色无水硫酸铜变蓝解答。二氧化硫经过稀高锰酸钾溶液后是湿润的气体解答。(1)仪器的名称①酒精灯,②集气瓶;(2)高锰酸钾在加热的条件下分解生成锰酸钾、二氧化锰和氧气,应选择的装置组合是AC;反应的化学方程式为2KMnO4![]() K2MnO4+MnO2+O2↑;若收集的氧气不纯,其可能原因有反应前集气瓶中未装满水;(3)①反应前后Cu、H、S、O的原子个数分别为1、4、2、8;0、4、1、4,故反应原理为Cu + 2H2SO4(浓)
K2MnO4+MnO2+O2↑;若收集的氧气不纯,其可能原因有反应前集气瓶中未装满水;(3)①反应前后Cu、H、S、O的原子个数分别为1、4、2、8;0、4、1、4,故反应原理为Cu + 2H2SO4(浓)![]() CuSO4+ SO2↑ + 2H2O;②G装置中将铜丝设计为可抽动,是为了控制反应的发生和停止;③生成物中的SO2是一种空气污染物,它会导致酸雨;④若要验证生成物中有SO2和水蒸气,合适的装置序号为G →K→I→尾气处理装置。
CuSO4+ SO2↑ + 2H2O;②G装置中将铜丝设计为可抽动,是为了控制反应的发生和停止;③生成物中的SO2是一种空气污染物,它会导致酸雨;④若要验证生成物中有SO2和水蒸气,合适的装置序号为G →K→I→尾气处理装置。

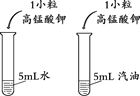
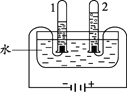
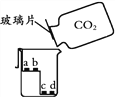
【题目】某小组进行了如下实验,请回答下列问题。
序号 | 甲 | 乙 | 丙 |
实验 |
|
|
a、c为干燥的紫色石蕊试纸 b、d为湿润的紫色石蕊试纸 |
(1)甲实验的目的是________。
(2)乙实验,若电解18g 水,则试管2内得到的气体质量为_____g 。
(3)丙实验,说明二氧化碳密度大于空气且能与水反应的现象是________________。
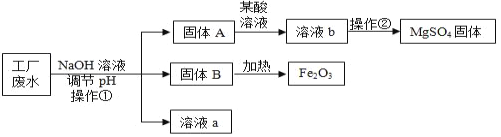
【题目】某工厂的废水中含有MgSO4和FeCl3等,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
资料:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Mg(OH)2 |
开始沉淀 | 1.9 | 9.1 |
完全沉淀 | 3.2 | 11.1 |
(1)操作①的名称__________,该工厂废水一定呈__________性。
(2)用NaOH溶液调节溶液的pH,pH的控制在__________范围内,可使废液中的铁离子(Fe3+)完全沉淀,而镁离子(Mg2+)又不损耗。
(3)操作②时,当__________即可停止加热。
(4)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为_____。
(5)溶液a除了可能含有NaOH外,还一定含有的溶质是________(填化学式)。
(6)配制2000kg质量分数为5%的氢氧化钠溶液,需要氢氧化钠______Kg。