题目内容
【题目】进行如下微型实验,研究物质的性质。
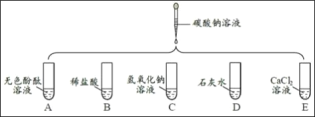
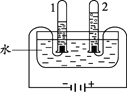
(1)A中无色酚酞溶液变为红色,证明碳酸钠溶液显_____性。
(2)B中产生大量气泡的原因是_____(用化学方程式解释)。
(3)碳酸钠溶液在鉴别C、D中的物质时,依据的不同现象是_____。
(4)E中发生复分解反应,产生白色沉淀,其反应的化学方程式为_____。
【答案】碱 Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 碳酸钠溶液与氢氧化钠溶液不反应,无现象;碳酸钠溶液与石灰水反应生成碳酸钙白色沉淀和水 Na2CO3 + CaCl2 == CaCO3 ↓+ 2NaCl
【解析】
(1)A 中无色酚酞溶液变为红色,证明碳酸钠溶液显碱性。
(2)B 中产生大量气泡的原因是Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑。
(3)碳酸钠溶液与氢氧化钠溶液不反应,无现象;碳酸钠溶液与石灰水反应生成碳酸钙白色沉淀和水。
(4)E 中发生复分解反应,产生白色沉淀,其反应的化学方程式为Na2CO3 + CaCl2 == CaCO3 ↓+ 2NaCl。

【题目】某小组进行了如下实验,请回答下列问题。
序号 | 甲 | 乙 | 丙 |
实验 |
|
|
a、c为干燥的紫色石蕊试纸 b、d为湿润的紫色石蕊试纸 |
(1)甲实验的目的是________。
(2)乙实验,若电解18g 水,则试管2内得到的气体质量为_____g 。
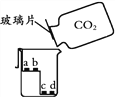
(3)丙实验,说明二氧化碳密度大于空气且能与水反应的现象是________________。
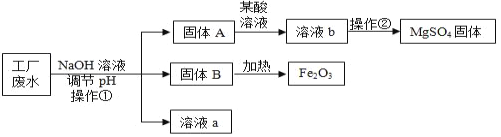
【题目】某工厂的废水中含有MgSO4和FeCl3等,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
资料:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Mg(OH)2 |
开始沉淀 | 1.9 | 9.1 |
完全沉淀 | 3.2 | 11.1 |
(1)操作①的名称__________,该工厂废水一定呈__________性。
(2)用NaOH溶液调节溶液的pH,pH的控制在__________范围内,可使废液中的铁离子(Fe3+)完全沉淀,而镁离子(Mg2+)又不损耗。
(3)操作②时,当__________即可停止加热。
(4)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为_____。
(5)溶液a除了可能含有NaOH外,还一定含有的溶质是________(填化学式)。
(6)配制2000kg质量分数为5%的氢氧化钠溶液,需要氢氧化钠______Kg。