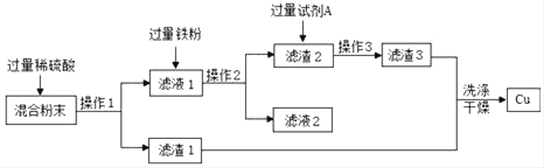
题目内容
【题目】下列化学方程式书写正确的是
A. 2Fe+6HCl→2FeCl3+3H2↑B. CuSO4+2NaOH→Cu(OH)2↓+Na2SO4
C. 3Fe+2O2→Fe3O4D. H2O![]() H2↑+O2↑
H2↑+O2↑
【答案】B
【解析】
A.铁和酸反应通常生成亚铁离子,而不是铁离子,正确的方程式为:Fe+2HCl→FeCl2+H2↑,故不符合题意;
B.硫酸铜和氢氧化钠反应生成蓝色的氢氧化铜沉淀和硫酸钠,通常采用该反应来制取波尔多液,故符合题意;
C.铁与氧气要在点燃的条件下才会生成四氧化三铁,若是铁在空气中则只生成红色的铁锈三氧化二铁,正确的方程式为:3Fe+2O2![]() Fe3O4;故不符合题意;
Fe3O4;故不符合题意;
D.水在通电的情况下,生成氧气和氢气,但是方程式没有配平,正确的方程式为:2H2O![]() 2H2↑+O2↑;故不符合题意。
2H2↑+O2↑;故不符合题意。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】某工厂的废水中含有MgSO4和FeCl3等,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如下图所示。
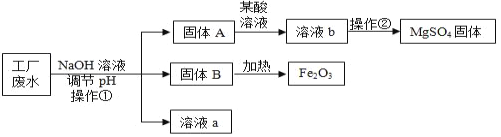
资料:部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Mg(OH)2 |
开始沉淀 | 1.9 | 9.1 |
完全沉淀 | 3.2 | 11.1 |
(1)操作①的名称__________,该工厂废水一定呈__________性。
(2)用NaOH溶液调节溶液的pH,pH的控制在__________范围内,可使废液中的铁离子(Fe3+)完全沉淀,而镁离子(Mg2+)又不损耗。
(3)操作②时,当__________即可停止加热。
(4)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为_____。
(5)溶液a除了可能含有NaOH外,还一定含有的溶质是________(填化学式)。
(6)配制2000kg质量分数为5%的氢氧化钠溶液,需要氢氧化钠______Kg。