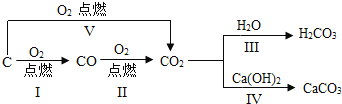
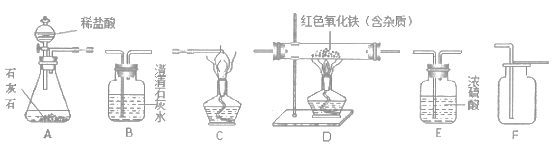
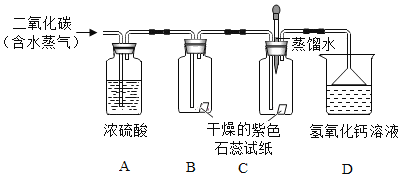
��Ŀ����
����Ŀ�����Ʊ������ǿ�ѧ̽���г��õķ�������ѧ��Ӧ�Ŀ���������������йأ����¶ȡ�ѹǿ���������������������ء�����ʵ����Ƶ�Ŀ����̽����ѧ��Ӧ��������������Ĺ�ϵ��
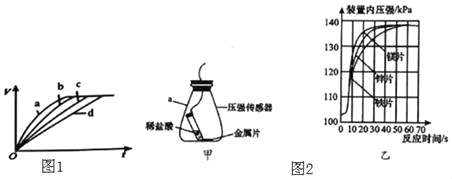
�������ķݵ����������ֱ���������������з�Ӧ��ͼ1Ϊ���ŷ�Ӧʱ��ı仯�����������V�Ĺ�ϵ���ߡ�����ʵ�������ֱ��ǣ�
a.50�桢���� b.30�桢���� c.30�桢��˿ d.20�桢��˿
��1����д���������ᷴӦ�Ļ�ѧ����ʽ��_____���÷�Ӧ����ʱ��ų�������
��2��ͨ��ʵ��a��b�Աȣ��ó��Ľ�����_____����Ҫ�ȽϽ������ı�����Է�Ӧ������Ӱ�죬Ӧѡ���ʵ�������_____��ʵ���й۲쵽�������塰����ֱ�����������͡���족��ԭ����_____��
��3������ʱ��������������п��þ���ֽ���Ƭ�ֱ���������ᷴӦ��ͼ2�У���ͼΪʵ�鷢��װ�ã���ͼΪ��õIJ�������������ͼ��ѹǿԽ��ʾ������������Խ�ࣩ��
����ʵ���У�����Ϊ����Ҫ���Ƶı�����_____��
��������ͼ���ó���Ӧ�����������H2����Ĺ�ϵ��_____��
��4����������þƬ�����ᷴӦ����ò���H2��ʵ��ֵ������ֵƫ����������ܵ�ԭ��д��һ�����ɣ���
_____��
���𰸡�Fe+2HCl��FeCl2+H2���� ��ͬ�����£��¶�Խ�ߣ��������ᷴӦ����Խ�죻 bd ����ϡ���ᷴӦ���ȣ���Ӧ���ʼӿ� �������Ŀ�����С���������IJ�ͬ�����ֱ�����ͬ�����ͬ������������ͬ�����ַ�Ӧ����������������� ��Ӧ���ȣ�ʹ�������ͣ� �����л������Ȼ������塣
��������
��1����������ϡ���ᷴӦ�����Ȼ��������������з�����
��2�����ÿ��Ʊ������Բ�ͬС���ʵ����з����Աȣ��ó���ȷ���ۣ��������ŷ�Ӧ�Ľ��У������Ũ�ȱ�С����Ӧ���ʱ������н��
��3�������ݿ��Ʊ��������з���������ϱ�����Ϣ��ͼ����Ϣ���������IJ�ͬ�����ֱ�����ͬ�����ͬ������������ͬ�����ַ�Ӧ����������������Ƚ��з������
��4�����Ƿ�Ӧ���ȣ�ʹ�������ͣ������л������Ȼ������壬���з�����
��1����������ϡ���ᷴӦ�����Ȼ���������������Ӧ�Ļ�ѧ����ʽΪ��Fe+2HCl��FeCl2+H2����
��2��ab����ʵ��������������ͬ��Ψ���¶Ȳ�ͬ���ɴ˵ó����ۣ���ͬ�����£��¶�Խ�ߣ��������ᷴӦ����Խ�죻bd����ʵ��������������ͬ��Ψ�н������ı������ͬ�������ڱȽϽ������ı�����Է�Ӧ������Ӱ�죻����ϡ���ᷴӦ���ȣ���Ӧ���ʼӿ죻
��3���ٴ˴�Ӧ���ƽ��������Ĵ�С��ͬ��
����ͼ�ң���ó��ķ�Ӧ����������ɵ���������Ĺ�ϵ�������IJ�ͬ�����ֱ�����ͬ�����ͬ������������ͬ�����ַ�Ӧ����������������ȣ�
(4)���ܵ�ԭ���У��ٷ�Ӧ���ȣ�ʹ�������͡��������л������Ȼ������塣

����Ŀ��ij��ѧ��ȤС������ʦ�İ����¶Լ��ֳ���������Ʒ�����Ľ�����������ص�̽�����
��������⣩(1)����������ٻƽ�(2)����ȷ���ٵĽ�����ԣ�
���������ϣ�(1)�ٻƽ�ͨ���ǻ�ͭ(Cu-Zn�Ͻ�)��
(2)��(Pd)������ɫ�н��������������Ʒ��
��ʵ��ҩƷ���١�Ǧ(Pt)��ϡ���ᡢ��������Һ���Ȼ�ڕ(PdC12)��Һ
��ʵ��̽����
(1)����ƽ���Ʒ�����
ȡ�ƽ���Ʒ���Թ��еμ�ϡ�����۲쵽�ƽ���Ʒ���������ݲ�����������______��˵������ƷΪ______(ѡ����������������)�ƽ�
(2)̽��ڕ�Ľ������
���������ͬѧ�Dz���ڕ�Ļ�Կ���������Ǧ�������������������ҩƷ��������ʵ�飺
ʵ�鲽�� | ʵ������ | ʵ����� |
���ٽ�����������Һ�� | ______ | �ٵĻ�Ա����� |
��Ǧ�����Ȼ�ڕ��Һ�� | ���������� | �ٵĻ�Ա�Ǧ ______ |
�����ó����ۣ��١�����Ǧ�Ľ��������ǿ������˳��Ϊ______��
(3)��ʢ���������������������Һ���ձ��м���һ������п�۷�Ӧֹͣ������������м���ϡ���������ݲ�����Һ��һ������______��������һ����______��
����Ŀ������صIJ����ܽ�����ݼ��±���
�¶ȣ��棩 | 10 | 20 | 40 | 60 |
�ܽ�ȣ�g/100g ˮ�� | 20.9 | 31.6 | 63.9 | 110 |
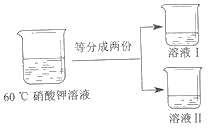
��20��ʱ����ȡ 10.0 ������ع�����뵽 40 ��ˮ�У���_____��д���������ƣ����裬����ܽ��õ�_____��ѡ��������������������������Һ��
�ڽ�������Һ������ 60�棬������Һ��������������Ϊ_____��
�۽� 60����������Һ������ͼ��ʾ������
����Һ I ���£���ʼ��������ؾ�����¶Ƚ���_____�棨ѡ����֮�䡣
A. 40-60 B. 20-40 C. 10-20 D. ���� 10
Ϊ�õ� 60��ʱ����ر�����Һ������Һ II �������� 15 ��ˮ��������ò����ܷ�ﵽʵ��Ŀ�IJ�˵������_____��