题目内容
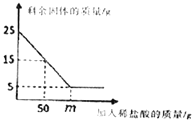
【题目】请根据图a、b、c三种固体物质的溶解度曲线,回答下列问题:
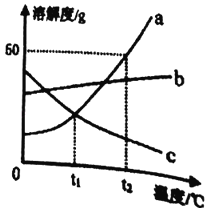
(1)在______℃时,a、c两种物质的溶解度相等。
(2)在t2℃时,向盛有50g a物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为______g。
(3)若a物质中混有少量b物质,最好采用______的方法提纯a物质(填“降温结晶”或“蒸发结晶”)。
(4)t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是______。
(5)下列说法正确的是______。
A.将a物质的饱和溶液变为不饱和溶液,其溶质的质量分数一定减小
B.将t1℃时c物质的饱和溶液升温到t2℃,其溶液的质量一定减小
C.配制一定溶质质量分数的b物质溶液,若量取水时俯视读数,其它操作均正确,则配制的b溶液中溶质的质量分数将偏高
【答案】t1 75 降温结晶 c>b>a BC
【解析】
(1)通过分析溶解度曲线可知,在t1℃时,a、c两种物质的溶解度相等;
(2)在t2℃ 时,a物质的溶解度是50g,所以向盛有50g a物质的烧杯中加入50g水,充分溶解后,所得溶液的质量为75g;
(3)a物质的溶解度受温度变化影响较大,所以若a物质中混有少量b物质,最好采用降温结晶的方法提纯a物质;
(4)t2℃ 时,a物质的溶解度最大,c物质的溶解度最小,所以a、b、c三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是c>b>a;
(5)A、将a物质的饱和溶液变为不饱和溶液,升高温度的方法,其溶质的质量分数不变,故错误;
B、将t1℃时c物质的饱和溶液升温到t2℃,溶解度减小,析出晶体,其溶液的质量一定减小,故正确;
C、配制一定溶质质量分数的b物质溶液,若量取水时俯视读数,量取水的体积偏小,其它操作均正确,则配制的b溶液中溶质的质量分数将偏高,故正确。
故选:BC。

【题目】硫酸(H2SO4)是一种用途广泛的化工原料,工业上常用煅烧黄铁矿(主要成分是FeS2)的方法来生产硫酸,简要的工艺流程图如下:
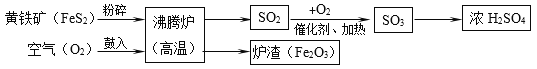
(1)黄铁矿投入沸腾炉前粉碎的目的是________。
(2)在沸腾炉中发生的反应为:(______)FeS2+(______)O2 ![]() (______)Fe2O3+(______)SO2(请在化学式前面配上适当的化学计量数),得到的炉渣(Fe2O3)可用来炼铁。
(______)Fe2O3+(______)SO2(请在化学式前面配上适当的化学计量数),得到的炉渣(Fe2O3)可用来炼铁。
(3)请写出流程中SO2转化为SO3的化学方程式_________。
(炉渣的综合利用)
为了实现炉渣(Fe2O3)的综合利用,工业上把炉渣和焦炭、石灰石一起投入高炉,主要反应过程如图:
![]()
(4)步骤②发生反应的化学方程式为______。
(5)下列有关高炉炼铁的说法正确的是_______(填序号)。
A.上述流程中涉及的三个反应均为吸热反应
B.上述步骤①反应中,还原剂是焦炭
C.焦炭的作用之一是为炼铁炉提供高温条件
D.焦炭的另一个作用是除去铁矿石中的杂质
(6)分析高炉所得的生铁中单质铁的含量:
小瑾同学为测定生铁中铁的质量分数,先后进行了四次实验,实验数据记录如下表。根据她的实验数据,试计算生铁中铁的质量分数是_________?
第一次 | 第二次 | 第三次 | 第四次 | |
所取生铁的质量∕g | 10 | 10 | 10 | 10 |
所加稀硫酸的质量∕g | 25 | 50 | 75 | 100 |
生成氢气的质量∕g | 0.10 | 0.20 | 0.30 | 0.35 |
(反思质疑)
小宇同学在梳理工业炼铁的相关知识时,提出了以下质疑:
(质疑一)焦炭也具有还原性而且成本低,工业炼铁为什么不直接用焦炭作为还原剂冶炼铁矿石?
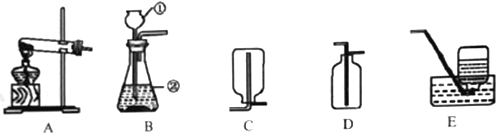
(7)他设计了下图所示的一组对比实验:称取两份相同质量的氧化铁粉末,一份与足量的焦炭粉末混合均匀放入装置A的试管中,另一份放入装置B的玻璃管中。
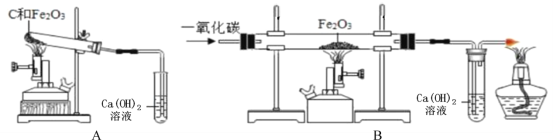
①装置B的玻璃管中发生反应的化学方程式为________。
②当他观察到装置B的玻璃管中固体_________、澄清石灰水变浑浊时,装置A
③通过上述实验对比,小宇同学认为工业上不直接用焦炭作为还原剂炼铁的主要原因有:反应不充分、反应速度慢、_______等。
(质疑二)装置B中反应后的黑色固体一定就是单质铁吗?
(查阅资料)
a.铁常见的氧化物有氧化铁(Fe2O3)、四氧化三铁(Fe3O4)和氧化亚铁(FeO)。
b.四氧化三铁是具有磁性的黑色晶体,氧化亚铁是不溶于水的黑色粉末,无磁性,也不能被磁铁吸引。
④小宇同学设计了如下实验方案:用磁铁吸引装置B进行实验后的黑色固体,发现黑色固体可以部分被吸引,由此得出结论:黑色固体的成分是___________。