题目内容
【题目】同学们用Na2CO3溶液和浓盐酸来研究简易灭火器的反应原理时,对废液的成分进行探究。
【推理假设】上述两种物质发生反应的化学方程式为_________________,由此推测出废液中一定有NaCl,可能有Na2CO3或盐酸。
【实验探究】(1)确定废液中是否含有碳酸钠。某同学选用pH试纸测出废液的pH________7(选填“大于”、“小于”、“等于”),确定废液中一定含有Na2CO3。
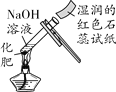
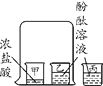
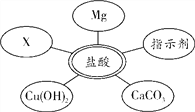
(2)确定废液中是否含有盐酸。①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X属于________(填物质类别);
②实验验证:某同学向废液中加入少量紫色石蕊溶液,观察到________________,确定废液中一定没有盐酸。
【拓展迁移】处理废液,回收利用,欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
方案 | 加入试剂 | 分离方法 | 方案评价 |
一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | 不可行,理由是______ |
二 | 过量的________ | 蒸发结晶 | 可行 |
【答案】 Na2CO3+2HCl=== 2NaCl+H2O+CO2↑ 大于 金属氧化物 溶液不显红色 碳酸钠与硝酸钙反应会生成可溶性的硝酸钠,最终晶体是氯化钠和硝酸钠的混合物 稀盐酸
【解析】【推理假设】碳酸钠和盐酸反应的化学方程式为: Na2CO3+2HCl=2NaCl+H2O+CO2↑;【实验探究】(1)Na2CO3的溶液显碱性,用pH试纸测出废液的pH大于7;(2)①根据盐酸的化学性质,同学们可选用石蕊、Mg、CuO、CaCO3、Cu(OH)2来检验是否含有盐酸;据图分析,可知X属于氧化物;②盐酸显酸性,能使紫色石蕊溶液变红,向废液中加入少量紫色石蕊溶液,观察到溶液不显红色,确定废液中一定没有盐酸;【拓展迁移】一、碳酸钠与硝酸钙反应会生成可溶性的硝酸钠,最终晶体是氯化钠和硝酸钠的混合物,该方案不可行;二、该方案可行,因为用过量的盐酸可以除去碳酸钠,过量的盐酸在蒸发时会挥发掉,不会留在氯化钠中。