题目内容
【题目】某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。
【提出问题】①三种溶液的酸碱性?
②它们与酸反应时溶液的pH如何变化?
【查阅资料】
pH | 2~3 | 4~6 | 7 | 8~9 | 10~11 | 12~14 |
紫甘蓝汁液显示的颜色 | 紫红 | 浅紫 | 紫色 | 蓝色 | 绿色 | 黄色 |
【实验1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 紫色 | 蓝色 | 绿色 | 黄色 |
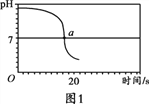
【实验2】向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
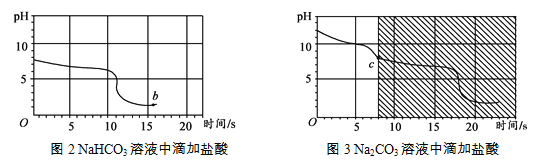
【实验3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。
【解释与结论】
(1)实验1得出三种溶液的碱性由强到弱的顺序为________________。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是_________,实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是_________。
(3)实验3中,b点的溶质为_________,c点后发生反应的化学方程式为_________。
(4)依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体的实验方案为________。
【答案】 氢氧化钠溶液>碳酸钠溶液>碳酸氢钠溶液 实验过程中溶液的pH由大于7到小于7,说明氢氧化钠被消耗 溶液变为紫红色 NaCl、HCl NaHCO3+ HCl=NaCl+ H2O+CO2↑ 取两种固体加水配成溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠。
【解析】(1)碳酸氢钠溶液使紫甘蓝汁液变蓝,其PH在8~9间,碳酸钠溶液使紫甘蓝汁液变绿,其PH在10~11间,氢氧化钠溶液使紫甘蓝汁液变黄,其PH在12~14间;(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是:实验过程中溶液的pH由大于7到小于7,说明氢氧化钠被消耗;实验结束后,盐酸剩余使溶液显酸性,使紫甘蓝汁液变成紫红色;(3) 碳酸氢钠和盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为:NaHCO3+ HCl=NaCl+ H2O+CO2↑;实验3中,b点说明盐酸过量,溶液中的溶质为:氯化钠、氯化氢;(4) 依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体各根据与盐酸反应产生气体的快慢判断,具体方案为:取两种固体加水配成溶液,分别逐滴加入盐酸,若立即产生气泡则为碳酸氢钠,若开始无气泡,一段时间后有气泡,则为碳酸钠。

 阅读快车系列答案
阅读快车系列答案【题目】用下列实验操作可完成两个实验。请从A或B 两题中任选一个作答,若两题均作答,按A 计分。
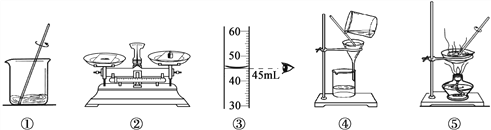
A去除粗盐中难溶性杂质 | B配制50g 10%的氯化钠溶液 |
(1)实验的操作步骤是___________(填序号)。 (2)实验中发现滤液浑浊,其原因是_____。 a.滤纸未贴紧漏斗内壁 b.滤纸破损 | (1)实验的操作步骤是____________(填序号)。 (2)实验后测得溶质质量分数<10%,其原因是_____。 a.装瓶时溶液洒出 b.烧杯中有水 |