题目内容
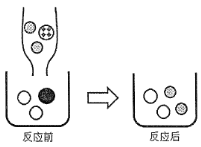
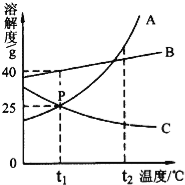
【题目】(5分)如图,A、B、C为三种物质的溶解度曲线,请根据图示信息回答下列问题.
(1)t1℃时,A、B、C三种物质中溶解度最大的是 _________ ;
(2)交点P表示t1℃时A、C两种物质的溶解度 _________ (填“相等”或“不相等”),这说明t1℃时25gA物质(或C物质)溶解在 _________ g水中能恰好形成饱和溶液.
(3)t1℃时,30gB物质投入100g水中,充分溶解,所得溶液为 _________ 溶液(填“饱和”或“不饱和”);
(4)t2℃时,A、B、C三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数的大小关系正确的是 _________ (填序号).
①A>B>C ②B>A>C ③B>A=C.
【答案】(1)B;(2)相等,100g;(3)不饱和;(4)②.
【解析】(1)由A、B、C为三种物质的溶解度曲线可知,在t1℃时,A、B、C三种物质中溶解度最大的是B;
(2)由A、C两种物质的溶解度曲线可知,在t1℃时,两物质的溶解度曲线交于P点,说明两物质的溶解度在t1℃时相等.由溶解度的意义可知,在t1℃时25gA物质(或C物质)溶解在100g水中能恰好形成饱和溶液;
(3)由B两种物质的溶解度曲线可知,在t1℃时,B物质的溶解度是40g.由溶解度的意义可知,t1℃时,30gB物质投入100g水中,充分溶解,所得溶液为不饱和溶液;
(4)t2℃时,A、B、C三种物质的饱和溶液溶质质量分数由大到小的顺序为:A>B>C;当降温到t1℃,A、B仍为饱和溶液,C为不饱和溶液.在t1℃,由于B溶解度大于A的溶解度,所以B的饱和溶液的溶质质量分数大于A饱和溶液的溶质质量分数;C的溶液的溶质的质量分数等于t2℃时饱和溶液的质量分数,由于A在t1℃时的溶解度大于C在t2℃的溶解度,故降温至t1℃,所得溶液中溶质的质量分数的大小顺序为 B>A>C.

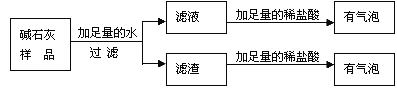
【题目】实验室有一包固体药品,可能含有BaSO4、Na2CO3、CuSO4、NaCl、CaCl2、NaOH中的一种或几种,为确定其成分,某班同学在老师的指导下进行探究。
(一)定性探究:
Ⅰ.称取少量样品,加入足量水中充分溶解,过滤后得到白色沉淀和无色滤液。由实验现象可知,原固体中一定不含____;
Ⅱ.取Ⅰ中得到的滤液少量,设计实验继续探究原固体的成分,请帮他们完成实验报告并回答问题。
操作 | 现象 | 结论 |
向滤液中加入足量氯化钙溶液 | 产生白色沉淀 | 原固体中一定含有____ |
取上层清液,滴加____ | ____ | 原固体中不含NaOH |
其中,步骤加入足量氯化钙溶液的目的除了检验一定含有的物质外,还能起到的作用是____;
Ⅲ.再取Ⅰ中得到的滤液少量,进行如下操作:
![]()
同学们认为:原固体中一定含有NaCl。但是老师指出这个结论不正确,其理由是___(填序号)
A.滤液中含有Na2CO3,也能和AgNO3反应生成沉淀
B.滤液中的NaCl可能是由原固体中的Na2CO3和CaCl2反应生成
(二)定量探究:
在老师的指导下同学们又精确称量了10g原固体,进行如下实验:
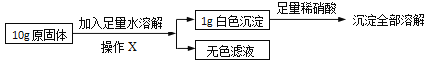
同学们认为,根据“沉淀全部溶解”的现象可确定白色沉淀的成分是____,则原固体中一定不含____;其中,操作X的名称是____,无色滤液中一定含有的阳离子是____。
试根据生成沉淀的质量计算原固体中氯化钙的质量分数,写出计算过程_____。