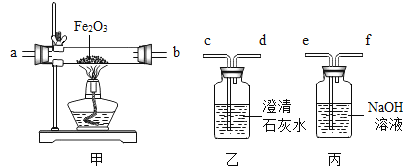
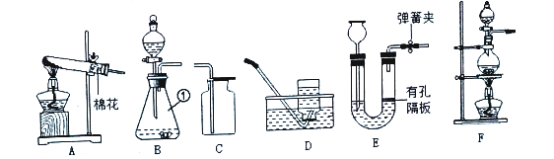
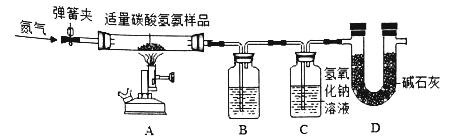
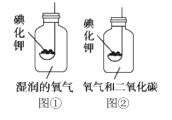
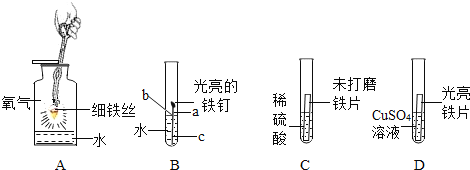
题目内容
【题目】根据图的有关信息。请回答下列问题。
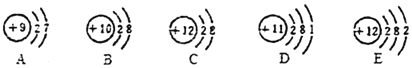
(1)微粒A、B、C、D、E共表示______种元素,属于同一种元素的是______(填编号下同);
(2)微粒A、B、C、D、E中,在化学反应中容易得电子的是______,表示阳离子的是______。
(3)A元素与E元素组成化合物的化学式是______。
(4)微粒E构成的单质在空气中燃烧时的现象是______。
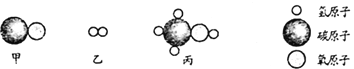
(5)甲和乙在催化剂、高温高压条件下反应生成丙,三种物质微观结构示意图如图2所示,该反应的化学方程式:______。
【答案】4 CE A C MgF2 发处耀眼的白光、生成了白色的固体,放出了大量的热 ![]()
【解析】
(1)由微粒的结构可知,微粒A、B、C、D、E中共有4种质子数,共表示4种元素,C、E的质子数相同,属于同一种元素;
(2)由微粒的结构可知,微粒A的最外层电子数是7,大于4,在化学反应中容易得电子,C的质子数=12>电子数=10,表示的阳离子。
(3)A元素是镁元素,化合价为+2价,E元素是氟元素,化合价为-1价,组成化合物的化学式是:MgF2。
(4)微粒E表示的元素是镁,构成的单质镁在空气中燃烧时的现象是:发处耀眼的白光、生成了白色的固体,放出了大量的热
(5)由微粒的结构可知,该反应是一氧化碳和氢气在催化剂、高温高压条件下反应生成甲醇,反应的化学方程式是:![]() 。
。

【题目】今年我省人大和政协两会使用了一种含碳酸钙的“石头纸”:为测定其中碳酸钙的含量,课外活动小组的同学称取50g碎纸样品。分别在5只烧杯中进行了实验,实验数据见下表(假设纸张其他成分既不溶于水,也不与酸反应):
烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ | |
加入样品的质量/g | 10 | 10 | 10 | 10 | 10 |
加入稀盐酸的质量/g | 10 | 20 | 30 | 40 | 50 |
充分反应后生成气体的质量/g | 0.88 | 1.76 | 2.64 | 3.52 | 3.52 |
(1)10g样品与足量稀盐酸反应最多生成_____g气体;
(2)上述实验中盐酸过量的是烧杯_____(填序号);
(3)求样品中碳酸钙的质量分数_____。(写出计算过程)