题目内容
【题目】小明同学在练习“金属的化学性质”实验操作时,发现几支试管中冒出气泡有快有慢,于是他与小芳同学一起合作进行如下探究。
(提出问题)金属与酸反应的快慢受哪些因素影响呢?
(猜想与假设)A.可能与酸的浓度有关;B.可能与金属的种类有关;C.可能与金属的形状有关。
(设计并实验)小明和小芳进行如下实验。
实验编号 | 盐酸的浓度(均取20ml) | 金属(均取2g) | 金属的形状 | 收集50ml氢气所需时间/s |
① | 10% | 镁 | 粉状 | 60 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 镁 | 片状 | 102 |
④ | 20% | 铁 | 片状 | 110 |
(1)实验时需将镁片和铁片进行打磨,其目的是___。
(2)写出铁与稀盐酸反应的化学方程式:____。
(收集证据)
(3)要比较不同种类的金属对反应快慢的影响,应选择的实验编号是____。
(得出结论)通过上述四个实验,你得出的影响金属与酸反应的因素有___。
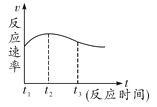
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应。实验测得该反应中产生气体的速率(v)与时间(t)的关系如图所示,你认为在t2 ~t3时间段内反应速率逐渐减慢的主要原因是___。
(实验反思)本实验采用的定量比较气体产生速率的方法是____。
【答案】除去金属表面的氧化物 Fe+2HCl=FeCl2+H2↑ ②③ 酸的浓度、金属的形状以及金属的种类 随着反应的进行,盐酸逐渐被消耗,盐酸的溶质质量分数变小,故反应速率逐渐减慢 收集相同体积的气体所需要的时间
【解析】
[设计并实验]
(1)镁和铁等金属的化学性质较活泼易在其表面形成氧化镁、氧化铁等,打磨后除去金属表面的氧化物有利于反应的进行;
(2)铁与盐酸反应会生成氢气及氯化亚铁,其方程式为:Fe+2HCl=FeCl2+H2↑;
[收集证据]
(3)要比较不同金属的种类对反应快慢的影响,就要选择不同的金属,但其它的因素都一样,因此选择的对比组是②③;
[得出结论]通过表格数据分析可知影响金属与酸反应快慢的因素有酸的浓度、金属的形状以及金属的种类;
[得出结论]
(4)从坐标可以看出反应由慢到快然后逐渐减慢;因为随着反应的进行,盐酸逐渐被消耗,盐酸的溶质质量分数变小,故反应速率逐渐减慢;
[实验反思]
本实验采用的定量比较气体产生速率的方法是收集相同体积的气体所需要的时间。