��Ŀ����
����Ŀ����W�β������������ʵ�顣
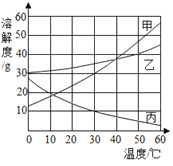
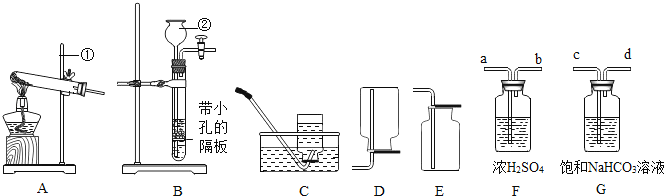
��1��̽����������
��ͼ1����������˼����Լ�X���۲쵽��ɫ��̪��Һ��죬ʪ��ĺ�ɫʯ����ֽ�������Լ�X������_____________�����۽ǶȽ�����������____________��
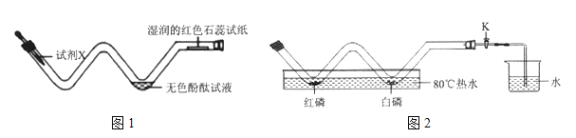
��2��̽��ȼ�������������Բⶨ�����������ĺ���
��ͼ2���ڲ������з��������ĺ��Ͱ��ף�������Ƥ�����ر�K���۲쵽���ײ�ȼ�ն�����ȼ�ա��������������ԭ����_____________����Ҫ�����ⶨ�����������ĺ�����������еIJ�����__________________������������ݡ�
���𰸡�Ũ��ˮ �����Ӳ�ͣ���������˶���ʹ��������ɢ���������Ҷ�ָʾ���� �¶ȴﵽ�����Ż�㣬��û�дﵽ�����Ż�� ��ȴ�����£��� K����ˮ��ֽ��벣���ܺ�
��������
������Һ��ʹ��ɫ��̪��Һ��죬��ʹ��ɫʯ����ֽ��������������˼����Լ�X���۲쵽��ɫ��̪��Һ��죬ʪ��ĺ�ɫʯ����ֽ�������Լ�X������Ũ��ˮ��Ũ��ˮ���лӷ��ԣ��ӷ����������ӣ����������ڲ����˶��������������˶��������̪��Һ�У���ˮ�Լ��ԣ���ʹ��̪��Һ��죬�������ӽӴ���ʪ��ĺ�ɫʯ����ֽ��ʹʪ��ĺ�ɫʯ����ֽ������
��1��������Һ��ʹ��ɫ��̪��Һ��죬��ʹ��ɫʯ����ֽ��������������˼����Լ�X���۲쵽��ɫ��̪��Һ��죬ʪ��ĺ�ɫʯ����ֽ�������Լ�X������Ũ��ˮ��Ũ��ˮ���лӷ��ԣ��ӷ����������ӣ����������ڲ����˶���ʹ��������ɢ���������Ҷ�ָʾ���ϡ�
��2���ڲ������з��������ĺ��Ͱ��ף�������Ƥ�����ر�K���۲쵽���ײ�ȼ�ն�����ȼ�ա��������������ԭ�����¶ȴﵽ�����Ż�㣬��û�дﵽ�����Ż�㡣��Ҫ�����ⶨ�����������ĺ�����������еIJ�����ȴ�����£��� K����ˮ��ֽ��벣���ܺ���������ݡ�

����Ŀ���������ε���������
���� | ��ѧʽ | ������ | ������ |
�Ȼ��� | _____ | _____ | _____ |
̼���� | _____ | _____ | _____ |
̼������ | _____ | _____ | _____ |
̼��� | _____ | _____ | _____ |
����ͭ | _____ | _____ | _____ |
����Ŀ��С��ͬѧ����ϰ�������Ļ�ѧ������ʵ�����ʱ�����ּ�֧�Թ���ð�������п���������������С��ͬѧһ�������������̽����
��������⣩�������ᷴӦ�Ŀ�������Щ����Ӱ���أ�
����������裩A�����������Ũ���йأ�B������������������йأ�C���������������״�йء�
����Ʋ�ʵ�飩С����С����������ʵ�顣
ʵ���� | �����Ũ��(��ȡ20ml) | ����(��ȡ2g) | ��������״ | �ռ�50ml��������ʱ�䣯s |
�� | 10% | þ | ��״ | 60 |
�� | 10% | �� | Ƭ״ | 120 |
�� | 10% | þ | Ƭ״ | 102 |
�� | 20% | �� | Ƭ״ | 110 |
(1)ʵ��ʱ�轫þƬ����Ƭ���д�ĥ����Ŀ����___��
(2)д������ϡ���ᷴӦ�Ļ�ѧ����ʽ��____��
���ռ�֤�ݣ�
(3)Ҫ�Ƚϲ�ͬ����Ľ����Է�Ӧ������Ӱ�죬Ӧѡ���ʵ������____��
���ó����ۣ�ͨ�������ĸ�ʵ�飬��ó���Ӱ��������ᷴӦ��������___��
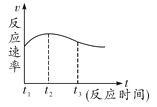
(4)ʵ������Թ���ڷ��̣�˵��þ��ϡ���ᷴӦ�Ƿ��ȷ�Ӧ��ʵ���ø÷�Ӧ�в������������(v)��ʱ��(t)�Ĺ�ϵ��ͼ��ʾ������Ϊ��t2 ��t3ʱ����ڷ�Ӧ������������Ҫԭ����___��
��ʵ�鷴˼����ʵ����õĶ����Ƚ�����������ʵķ�����____��