题目内容
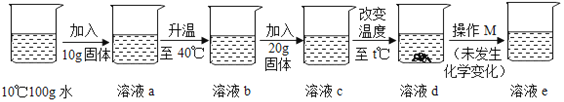
【题目】某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠回体样品,进行如图所示的实验.
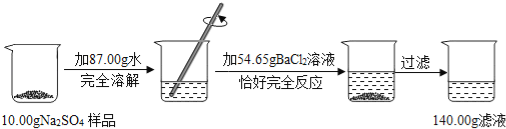
请跟据以上信息计算(结果保留到小数点后两位)
(1)反应生成沉淀的质量为 g.
(2)样品中硫酸钠的质量.
(3)求滤液中氯化钠的质量分数.
【答案】(1)11.65 (2)7.1g (3)6.25%
【解析】
试题(1)根据质量守恒定律,反应生成沉淀的质量为10g+87g+54.65g﹣140g=11.65g;
故答案为:11.65;
(2)解:设样品中硫酸钠的质量为x,反应中生成的氯化钠质量为y.
Na2SO4+BaCl2=BaSO4↓+2NaCl
142 233 117
x 11.65 g y
142:233=x:11.65g,解得x=7.1g
(3)233:117=11.65g:y,解得y=5.85g
滤液中氯化钠的质量=10.00g﹣7.1g+5.85g=8.75g
滤液中氯化钠的质量分数为:![]() ×100%=6.25%.
×100%=6.25%.
答:(2)样品中硫酸钠的质量为7.1g;(3)滤液中氯化钠的质量分数为6.25%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
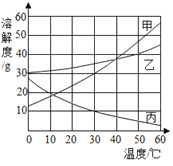
小学生10分钟应用题系列答案【题目】同学们在学习碱的化学性质时,进行了如图所示的实验.

(1)分别写出甲、乙、丙实验中发生反应的化学方程式:
甲_____;乙_____;丙_____.
从微观的角度看,丙反应的实质是_____.
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是_____.
(3)丙实验中观察到试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问.
[提出问题]废液中含有哪些物质?
[交流讨论]①一定含有的物质:碳酸钙、指示剂、水和_____(写物质名称).
②还含有能使废液呈碱性的物质.
能使废液呈碱性的物质是什么?同学们有如下猜想.
小云认为:只有碳酸钠
小红认为:只有氢氧化钙
小林认为:是氢氧化钠和碳酸钠
你认为还可能是_____(写一种猜想).
[实验设计]小方想用氯化钙溶液来验证小云、小红、小林的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小方的实验设计补充完整.
实验内容 | 预计现象 | 预计结论 |
取少量废液缸中上层清液 于试管中,加入过量 氯化钙溶液,静置. | ①有白色沉淀,溶液呈红色. | _____的猜想正确. |
②_____. | _____的猜想正确. | |
③_____. | _____的猜想正确. |
[反思拓展]在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑_____.
【题目】常见的盐的组成填表:
名称 | 化学式 | 阴离子 | 阳离子 |
氯化钠 | _____ | _____ | _____ |
碳酸钠 | _____ | _____ | _____ |
碳酸氢钠 | _____ | _____ | _____ |
碳酸钙 | _____ | _____ | _____ |
硫酸铜 | _____ | _____ | _____ |
【题目】小明同学在练习“金属的化学性质”实验操作时,发现几支试管中冒出气泡有快有慢,于是他与小芳同学一起合作进行如下探究。
(提出问题)金属与酸反应的快慢受哪些因素影响呢?
(猜想与假设)A.可能与酸的浓度有关;B.可能与金属的种类有关;C.可能与金属的形状有关。
(设计并实验)小明和小芳进行如下实验。
实验编号 | 盐酸的浓度(均取20ml) | 金属(均取2g) | 金属的形状 | 收集50ml氢气所需时间/s |
① | 10% | 镁 | 粉状 | 60 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 镁 | 片状 | 102 |
④ | 20% | 铁 | 片状 | 110 |
(1)实验时需将镁片和铁片进行打磨,其目的是___。
(2)写出铁与稀盐酸反应的化学方程式:____。
(收集证据)
(3)要比较不同种类的金属对反应快慢的影响,应选择的实验编号是____。
(得出结论)通过上述四个实验,你得出的影响金属与酸反应的因素有___。
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应。实验测得该反应中产生气体的速率(v)与时间(t)的关系如图所示,你认为在t2 ~t3时间段内反应速率逐渐减慢的主要原因是___。
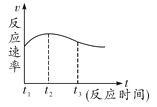
(实验反思)本实验采用的定量比较气体产生速率的方法是____。