题目内容
【题目】两会的焦点之一是环保及能源问题,为了解决环保以及能源问题,有科学家提出一种新的构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经过化学反应后转变为甲醇(CH3OH)。此构想技术简要流程如图所示。
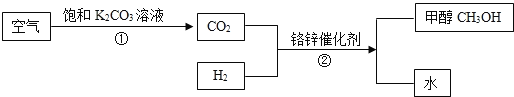
(1)写出流程中一种非可燃性单质的名称_____。
(2)写出步骤②的化学反应方程式_____。
(3)步骤②中铬锌催化剂在反应前后_____和质量不变。
(4)甲醇和乙醇同属醇类,请推测甲醇的一个化学性质_____。
(5)还有人认为把大气中CO2通入深海也可以一定程度上解决过多的CO2,但专家认为这样会造成海洋_____,导致珊瑚礁(主要成分是碳酸钙)消失。
【答案】氮气 CO2+3H2![]() CH3OH+H2O 化学性质 可燃性 酸性增大
CH3OH+H2O 化学性质 可燃性 酸性增大
【解析】
(1)因为空气的主要成分为氧气和氮气,故流程中一种非可燃性单质的名称氮气。
(2)二氧化碳和氢气在铬锌催化剂的催化作用下生成甲醇和水,化学方程式为:CO2+3H2![]() CH3OH+H2O;
CH3OH+H2O;
(3)在化学变化中可以改变化学反应速率,而本身的质量和化学性质在化学反应前后都保持不变的物质叫催化剂,所以步骤②中铬锌催化剂在反应前后质量和和化学性质不变;
(4)乙醇在实验室通过燃烧可以为一些化学反应提供热量,在日常生活中也可以通过燃烧提供能量,所以乙醇具有可燃性,通过类比思想可知,甲醇也具有可燃性。
(5)还有人认为把大气中CO2通入深海也可以一定程度上解决过多的CO2,但专家认为这样会造成海洋酸性增大,导致珊瑚礁(主要成分是碳酸钙)消失。
故答案为:
(1)氮气。(2)CO2+3H2![]() CH3OH+H2O。(3)化学性质。(4)可燃性。(5)酸性增大。
CH3OH+H2O。(3)化学性质。(4)可燃性。(5)酸性增大。

【题目】小明同学在练习“金属的化学性质”实验操作时,发现几支试管中冒出气泡有快有慢,于是他与小芳同学一起合作进行如下探究。
(提出问题)金属与酸反应的快慢受哪些因素影响呢?
(猜想与假设)A.可能与酸的浓度有关;B.可能与金属的种类有关;C.可能与金属的形状有关。
(设计并实验)小明和小芳进行如下实验。
实验编号 | 盐酸的浓度(均取20ml) | 金属(均取2g) | 金属的形状 | 收集50ml氢气所需时间/s |
① | 10% | 镁 | 粉状 | 60 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 镁 | 片状 | 102 |
④ | 20% | 铁 | 片状 | 110 |
(1)实验时需将镁片和铁片进行打磨,其目的是___。
(2)写出铁与稀盐酸反应的化学方程式:____。
(收集证据)
(3)要比较不同种类的金属对反应快慢的影响,应选择的实验编号是____。
(得出结论)通过上述四个实验,你得出的影响金属与酸反应的因素有___。
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应。实验测得该反应中产生气体的速率(v)与时间(t)的关系如图所示,你认为在t2 ~t3时间段内反应速率逐渐减慢的主要原因是___。
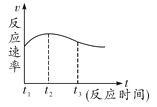
(实验反思)本实验采用的定量比较气体产生速率的方法是____。