题目内容
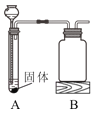
【题目】为了比较甲、乙两种金属的活动性强弱,小明设计了如图实验装置。他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(相同质量分数)进行反应。在相同条件下测定不同时间内产生氢气的体积,实验记录如下表:
反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 |
甲金属生成氢气的体积(毫升) | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
乙金属生成氢气的体积(毫升) | 30 | 75 | 120 | 150 | 150 | 150 | 150 |
(1)除了图示装置,实验中还需要用到的测量仪器有______。
(2)由实验结果可知:金属活动性较强的是______。
(3)为使得到的实验数据准确,应该从______时开始收集气体。
【答案】托盘天平 乙 导管口一有气泡冒出
【解析】
(1)要称量药品的质量,除了图示装置,实验中还需要用到的测量仪器有托盘天平,故填:托盘天平;
(2)由实验结果可知:在相同的时间内乙金属与酸反应生成的氢气多,则金属活动性较强的是乙,故填:乙;
(3)因为要测定金属产生氢气的快慢,应该是收集金属反应产生的所有气体,因为两者装置中都有空气,因此可以不考虑装置中空气的影响,故当导管口一有气泡冒出时就要收集,故填:导管口一有气泡冒出。

【题目】一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学。
(1)工业上用天然气和水蒸气在高温条件下发生反应,得到CO和H2,该反应的化学方程式为_____,得到的CO和H2的混合气被称为合成气,合成气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属。
(2)某他学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性。
I.用甲烷和水蒸气在高温条件下反应得到合成气。根据(1)中所写的化学方程式。合成气中CO和H2的质量比为_____。
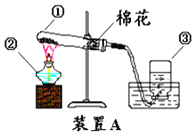
Ⅱ.用合成气还原足量氧化铜。实验装置如图所示:

(设计买验步骤)
①连接好装置并检查气密性。
②装入药品,通入一段时间合成气。
③分别称量装置D、E的质量。
④缓缓通入合成气,加热装置C,使其充分反应。
⑤停止加热,继续通入合成气至恢复到室温。
⑥再次分别称量装置D、E的质量。
(完善实验设计)经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤_____(填实验步骤的序号)中点燃(点燃前应对气体验纯)。
(进行实验)该小组的同学按上述步骤进行实验,并记录了实验现象和数据:
①装置C中出现_____色物质。
②称量数据如表所示。
装置D的质量 | 装置E的质量 | |
反应前 | 292.4g | 198.2g |
反应后 | 296.0g | 201.5g |
(现象分析和数据处理)
①甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO。
②乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中可能还有未反应的CH4,且CH4也还原了CuO.试通过计算说明他的推测依据_____。
③丙同学提出,实验步骤⑤中通入的气体会带走装置E中的部分水蒸气,使实验产生误差。你认为该误差对乙同学的推测结果是否有影响?_____(选填“是”或“否”,并说明理由)。
(拓展探究)该小组同学对于CH4是否真的能够还原氧化铜提出了质疑并进行探究。
查阅资料:甲烷具有还原性,可以还原氧化铜,生成CO2和H2O;白色的无水硫酸铜遇水会变成蓝色。
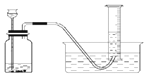
实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验。

①如图装置F中盛放的试剂名称是_____。
②如图装置的正确连接顺序是_____(填字母,且每套装置限用一次)。
(实验反思)除了可能是CH4也还原了CuO外,出现上表数据关系还可能是因为_____(写出一个原因,并说明理由)。