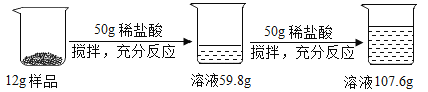
题目内容
【题目】完成下列变化的文字表达式,并按要求填空。
(1)实验室加热铜绿:________,观察到试管中固体由绿色逐渐变为________色。
(2)加热高锰酸钾制氧气的反应:________,基本反应类型为________反应。
(3)硫在氧气中燃烧:________,观察到的现象为________。
(4)二氧化碳通入澄清石灰水:________,看到澄清石灰水________,证明是二氧化碳。
(5)铁丝在氧气中燃烧:________,在集气瓶底留少量水的目的是________。
【答案】碱式碳酸铜![]() 氧化铜+水+二氧化碳 黑 高锰酸钾
氧化铜+水+二氧化碳 黑 高锰酸钾![]() 锰酸钾+二氧化锰+氧气 分解 硫+氧气
锰酸钾+二氧化锰+氧气 分解 硫+氧气![]() 二氧化硫 发出蓝紫色火焰,放热,生成一种有刺激性气味的气体 二氧化碳+氢氧化钙→碳酸钙+水 澄清石灰水变浑浊 铁+氧气
二氧化硫 发出蓝紫色火焰,放热,生成一种有刺激性气味的气体 二氧化碳+氢氧化钙→碳酸钙+水 澄清石灰水变浑浊 铁+氧气![]() 四氧化三铁 防止生成物熔化后溅落下来炸裂瓶底。
四氧化三铁 防止生成物熔化后溅落下来炸裂瓶底。
【解析】
(1)铜绿的主要成分为碱式碳酸铜,受热分解可生成氧化铜、水和二氧化碳,文字表达式为碱式碳酸铜![]() 氧化铜+水+二氧化碳,氧化铜为黑色固体;
氧化铜+水+二氧化碳,氧化铜为黑色固体;
(2)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,表达式为高锰酸钾 ![]() 锰酸钾+二氧化锰+氧气;该反应为分解反应;
锰酸钾+二氧化锰+氧气;该反应为分解反应;
(3)硫在氧气中燃烧生成二氧化硫,表达式为硫+氧气![]() 二氧化硫,该反应的现象为发出蓝紫色火焰,放热,生成一种有刺激性气味的气体;
二氧化硫,该反应的现象为发出蓝紫色火焰,放热,生成一种有刺激性气味的气体;
(4)二氧化碳通入石灰水中,是二氧化碳与氢氧化钙反应生成碳酸钙和水,表达式为二氧化碳+氢氧化钙 → 碳酸钙+水,当澄清石灰水变浑浊,则说明是二氧化碳;
(5)铁丝在氧气中燃烧是铁与氧气反应生成四氧化三铁,表达式为铁+氧气 ![]() 四氧化三铁,该反应发生时生成物熔化后溅落下来会炸裂瓶底,所以瓶底要预先放少量水。
四氧化三铁,该反应发生时生成物熔化后溅落下来会炸裂瓶底,所以瓶底要预先放少量水。

【题目】过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂以及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:2CaO2+2H2O=2Ca(OH)2+O2。
(1)若用150g某过氧化钙工业样品可制得氧气32g,请计算该过氧化钙样品的纯度(样品中CaO2的质量分数)是多少?
(2)往150g上述过氧化钙工业样品中逐渐加入水至过量,在图中画出产生氧气的曲线图。

(3)下表为市面上某种过氧化钙和过氧化钠(化学式为Na2O2,化学性质与CaO2类似)样品的一些数据:
物质 | 相对分子质量 | 纯度 | 价格(元/kg) |
Na2O2 | 78 | 98% | 25 |
CaO2 | 72 | 94% | 24 |
用3000元购买样品制氧气,请通过计算说明购买哪种产品可制得更多的O2(已知用3000元购买过氧化钙样品可制得26.1kg O2)?
【题目】实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验。

①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克,
②向上述3个烧杯中分别加入3 份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出)。实验数据记录如下:
实验一 | 实验二 | 实验三 | |
反应前稀盐酸+烧杯质量(克) | 150 | 150 | 150 |
反应前固体样品质量(克) | 4 | 8 | 12 |
反应后烧杯内物质+烧杯质量(克) | m | 155.8 | 158.7 |
已知实验中发生的化学反应:NaOH+HCl=NaCl+H2O
Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑
(1)分析表中教据,写出判断实验二中的样品已完全反应的理由__________。
(2)表中的m 值为________。
(3)根据实验二的数据计算样品中Na2CO3的质量分数。
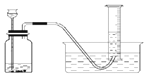
【题目】为了比较甲、乙两种金属的活动性强弱,小明设计了如图实验装置。他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(相同质量分数)进行反应。在相同条件下测定不同时间内产生氢气的体积,实验记录如下表:
反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 |
甲金属生成氢气的体积(毫升) | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
乙金属生成氢气的体积(毫升) | 30 | 75 | 120 | 150 | 150 | 150 | 150 |
(1)除了图示装置,实验中还需要用到的测量仪器有______。
(2)由实验结果可知:金属活动性较强的是______。
(3)为使得到的实验数据准确,应该从______时开始收集气体。