题目内容
【题目】热电厂燃烧煤会产生大量的SO2气体,为减少空气污染并利用SO2,热电厂用下面的方法使烟气脱硫从而生成石膏(CaSO42H2O),生产石膏板。

(1)通过操作1将烧碱溶液和CaSO3固体分离,操作I为_____。
(2)生产流程中,循环利用的物质是_____节约了成本。
(3)“制碱釜”中发生复分解反应,反应的化学方程式为_____。
(4)“氧化塔”中发生的反应为CaSO3+O2+2H2O=CaSO42H2O,在该反应中,化合价发生改变的元素有_____。
【答案】过滤; 氢氧化钠溶液; Ca(OH)2+Na2SO3═CaSO3↓+2NaOH; 硫、氧
【解析】
(1)操作1将烧碱溶液和CaSO3固体分离,操作I为过滤操作。
(2)既是反应物,也是生成物的物质,可以循环使用,生产流程中,可循环利用的物质是氢氧化钠溶液。
(3)“制碱釜”中发生复分解反应,是亚硫酸钠与氢氧化钙反应生成亚硫酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2SO3=CaSO3↓+2NaOH。
(4)CaSO3+O2+2H2O=CaSO42H2O,单质中元素的化合价为0,氧元素的化合价可能会发生改变;在该反应中,CaSO3中硫元素的化合价为+4价,CaSO42H2O中硫元素的化合价为+6价,化合价发生改变的元素有硫、氧元素,

【题目】某化学学习小组在老师的指导下,对白色粉笔的成分进行探究。
(提出问题)白色粉笔的主要成分是什么呢?老师提示是一种常见的钙盐与少量性质稳定的粘合剂制成的。
(猜想与假设)同学分别做出如下猜想:
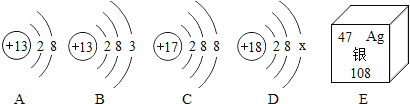
A 碳酸钙 B 氢氧化钙 C 硫酸钙 D 氯化钙 E 硝酸钙
同学们根据老师提示并讨论,立即否定了B的猜想,你认为理由是________.
(查阅资料)
(1)硫酸钙是自然界中石膏矿的主要成分,为白色固体,微溶于水.
(2)室温下几种物质的溶解度
物质 | 碳酸钙 | 氯化钙 | 硫酸钙 | 硝酸钙 |
溶解度/g | 0.0013 | 74.5 | 0.3 | 138 |
(进行实验)
实验操作 | 现象 | 结论 | |
① | 取少量白色粉笔研碎于试管中,加入________ | 无现象 | A不成立 |
② | 取少量白色粉笔研碎于烧杯中,加入少量水,搅拌 | 固体没有明显减少 | ________不成立 |
③ | 将②进行________操作,得到清液A和固体,向清液中加入 ____________溶液,再加入足量稀盐酸 | 产生白色沉淀,沉淀不消失 | C成立 |
请写出③中发生反应的化学方程式___________.
(拓展延伸)为了测定生石膏的组成(CaSO4·xH2O),即测定x的值,做了如下实验:将含结晶水的硫酸钙放在坩埚中加热,加热前和加热后都进行称量.随着实验次数的增加,加热的时间不断延长,他们在实验中将数据整理如下,并利用数据绘制的图象如图所示。
查阅资料:含结晶水的硫酸钙有两种组成形式,在加热过程中,分步失去结晶水,最终得到硫酸钙固体。
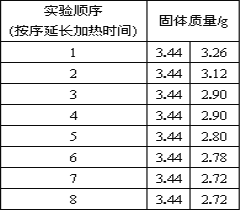
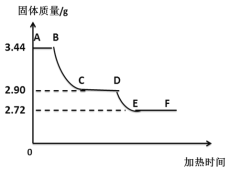
(1)AB段固体质量不变的原因__________。
(2)利用实验数据,计算x= ________.
(3)图中CD段固体物质的化学式 _____________.