题目内容
【题目】下列说法正确的个数有( )
①硝酸钾中混有少量的氯化钠,可用蒸发结晶的方法提纯硝酸钾
②合金中各成分均以单质形式存在,且合金中至少存在两种金属元素。
③某不纯的铁 5.6 克与足量的稀硫酸反应生成 0.23 克氢气,则铁中混有的物质可能是锌
④有一些金属与稀硫酸反应放出气体,与稀硫酸反应放出气体的物质不一定是金属
⑤有机化合物含有含碳元素,含碳元素的一定是有机化合物
⑥4A+5B=4C+6D,已知 C 与 D 的相对分子质量之比为 5:3,现将 17g A,与一定质量B恰好完全反应,生成 30g C,则该反应中 B 与 D 的质量比为 40:27
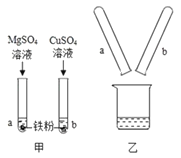
⑦为比较 Mg、Fe、Cu 三种金属的活动性顺序,进行了如图甲所示的实验。实验后把两试管中的物质倒入烧杯中(如图乙),发现烧杯内的红色固体明显增多,充分反应后过滤。滤液中含有的金属离子可能的组成有:(1)Fe2+和 Mg2+ (2)Fe2+和 Cu2+和 Mg2+
A. 3 个B. 4 个C. 5 个D. 6 个
【答案】A
【解析】
①根据硝酸钾的溶解度受温度的影响较大,氯化钠的溶解度受温度的影响较小,可用降温结晶的方法提纯硝酸钾,①不正确;
②根据合金的概念,合金中各成分均以单质形式存在,但合金中至少存在一种金属元素,②不正确;
③由于消耗相等质量的金属,铁产生氢气比锌多,某不纯的铁 5.6 克与足量的稀硫酸反应生成 0.23 克氢气,则铁中混有的物质是得氢气能力更强的铝或镁,③不正确;
④与稀硫酸反应放出气体的物质不一定是金属,可能是碳酸盐,④正确;
⑤有机化合物含有含碳元素,但含碳元素的不一定是有机化合物,如碳的氧化物和单质等,⑤不正确;
⑥根据:4A+5B=4C+6D,已知 C 与 D 的相对分子质量之比为 5:3,现将 17g A,与一定质量B恰好完全反应,生成 30g C,则D为27g,B为40g,则该反应中 B 与 D 的质量比为 40:27,⑥正确;
⑦由于镁的活动性大于铁,铁不能与硫酸镁反应;铁的活动性大于铜,铁能将铜从其溶液中置换出来,由题意可知,实验后把两试管中的物质倒人烧杯中(如图乙)发现烧杯内的红色固体明显增多,说明了乙中的铁完全反应了,甲中的铁又与硫酸铜发生了反应。若硫酸铜完全反应了,溶液中的阳离子是:Mg2+和Fe2+;若硫酸铜没有完全反应,溶液中的阳离子是:Mg2+、Fe2+和Cu2+,正确。
故选:A。

 名校课堂系列答案
名校课堂系列答案【题目】在一定条件下,一个密闭容器内发生某反应,测得反应前后各物质的质量如下表所示。下列有关说法不正确的是( )
物质 | a | b | c | d |
反应前的质量(g) | 30 | 20 | 10 | 15 |
反应后的质量(g) | X | Y | 0 | 10 |
A. 参加反应的c与d的质量比为2:1
B. 当Y=20时,b一定是催化剂
C. 当Y=20时,该反应是化合反应
D. 反应后容器中物质总质量为75g