题目内容
【题目】宝钢湛江钢铁基地项目位于湛江市东海岛,2015年11月一号高炉点火生产钢铁。在炼铁工业中,常用石灰石将铁矿石中的杂质二氧化硅转化为炉渣除去,发生反应的化学方程式为:CaCO3+SiO2![]() X+CO2↑,其中X的化学式是( )
X+CO2↑,其中X的化学式是( )
A. CaSiO4B. Ca2SiO3C. CaSi2O3D. CaSiO3
【答案】D
【解析】
由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式CaCO3+SiO2![]() X+CO2↑,反应前钙、碳、氧、硅原子个数分别为1、1、5、1,反应后的生成物中钙、碳、氧、硅原子个数分别为0、1、2、0,根据反应前后原子种类、数目不变,则每个X分子由1个钙原子、1个硅原子和3个氧原子原子构成,则物质X的化学式为CaSiO3.
X+CO2↑,反应前钙、碳、氧、硅原子个数分别为1、1、5、1,反应后的生成物中钙、碳、氧、硅原子个数分别为0、1、2、0,根据反应前后原子种类、数目不变,则每个X分子由1个钙原子、1个硅原子和3个氧原子原子构成,则物质X的化学式为CaSiO3.
故选:D.

 阅读快车系列答案
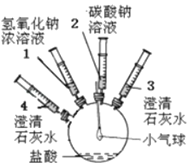
阅读快车系列答案【题目】某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
④____ | 无明显现象 | |
⑤将注射器4中的溶液推入瓶中 |
(1)步骤①中气球变瘪的原因_____;
(2)步骤②发生反应的方程式_____;
(3)步骤④的操作是_____,其目的是_____;
(4)步骤⑤中实验现象_____;反应方程式_____。
【题目】氢氧化钠和氢氧化钙是两种常见的碱,化学实验活动课上,同学们进行了如图所示的实验。
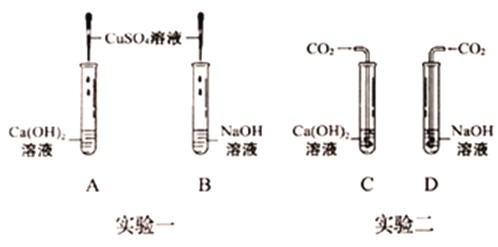
(1)实验一中,B试管中发生反应的化学方程式为_____。
A、B两支试管中共同的实验现象是_____。
(2)实验二中,C试管中有白色沉淀生成,该白色沉淀是_____(填化学式)。D试管中无现象,为了探究通入二氧化碳后D试管中溶质的成分,同学们进行了如下探究。
(提出猜想)猜想1:溶质是NaOH。
猜想2:溶质是NaOH和Na2CO3
猜想3:溶质是Na2CO3
实验操作 | 实验现象 | 实验结论 |
①取D中少量溶液于试管中加入过量稀盐酸 | _____ | 猜想1不成立 |
②取D中少量溶液于另一试管中,加入过量的Ca(OH)2溶液,过滤,取滤液加入酚酞溶液 | 产生白色沉淀,酚酞溶液变红 | 猜想2成立 |
(反思与评价)I.小军评价实验操作②中加入Ca(OH)2溶液不正确,理由是_____。
若要验证猜想2成立,需将Ca(OH)2溶液换成_____溶液。
Ⅱ在实验室中氢氧化钠固体密封保存的原因是_____(用文字叙述)
【题目】某实验学校初三兴趣小组利用如下装置(部分固定装置已略去)。制备氮化钙,并探究其化学式
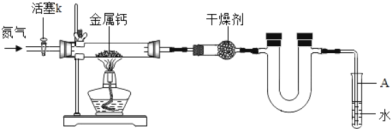
(1)反应过程中末端导管必须插入试管A的水中,目的是_____。
(2)制备氮化钙的操作步骤是:①打开活塞k并通入N2;②点燃酒精灯,进行反应;③反应结束后,_____;④拆除装置,取出产物。
(3)数据记录如下:
空硬玻璃管质量m0/g | 硬玻璃管与钙的质量m1/g | 硬玻璃管与产物的质量m2/g |
114.8 | 120.8 | 122.2 |
①计算得到化学式(实验式)CaxN2,其中x=_____。
②若通入的N2中混有少量O2,如上计算得到的x的值_____ (填写“偏大”、“偏小”、“不变”),判断依据是_____。
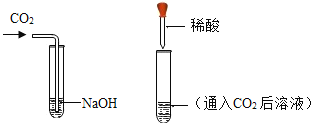
【题目】化学课上,老师将CO2分别通入澄清的石灰水和NaOH溶液中,我们观察到前者变浑浊,后者无明显现象,CO2和NaOH是否确实发生了化学反应?
(1)我设计了甲、乙两个实验来验证,如图所示,实验现象为:甲——软塑料瓶变瘪,乙——“瓶吞鸡蛋”。小虎同学认为上述实验是可行的,其共同原理是:_________。小余同学提出了质疑,他认为上述实验还不足以证明CO2与NaOH确实发生了反应,其理由是:______________。我思考后,又补充了一个实验来回答,这个实验是:_________。
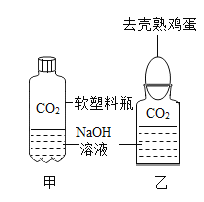
(2)小余同学认为可利用与上述实验不同的原理,设计如下实验方案,我来帮他完成:
实验步骤和方法 | 实验现象 | 实验结论 | |
方案一 |
| ________ | 二氧化碳和氢氧化钠发生了化学反应 |
方案二 | ________ | ________ |
写出方案2中所涉及的化学方程式________________。
(3)由此探究,我得到的启示是:________________。