题目内容
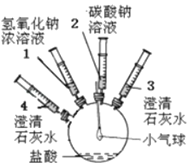
【题目】某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
④____ | 无明显现象 | |
⑤将注射器4中的溶液推入瓶中 |
(1)步骤①中气球变瘪的原因_____;
(2)步骤②发生反应的方程式_____;
(3)步骤④的操作是_____,其目的是_____;
(4)步骤⑤中实验现象_____;反应方程式_____。
【答案】将注射器4稍稍向外拉 盐酸和碳酸钠反应生成二氧化碳,导致瓶内气压增大 Ca(OH)2+CO2═CaCO3↓+H2O 将注射器4稍稍向外拉; 检验瓶内二氧化碳是否完全反应 溶液变浑浊; Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。
【解析】
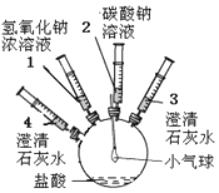
实验装置及方案:
实验过程如下所示:
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
④将注射器4稍稍向外拉 | 无明显现象 | |
⑤将注射器4中的溶液推入瓶中 | 溶液变浑浊 |
(1)步骤①中气球变瘪的原因:盐酸和碳酸钠反应生成二氧化碳,导致瓶内气压增大。
故填:盐酸和碳酸钠反应生成二氧化碳,导致瓶内气压增大。
(2)步骤②:氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,发生反应的方程式:Ca(OH)2+CO2═CaCO3↓+H2O。
故填:Ca(OH)2+CO2═CaCO3↓+H2O。
(3)步骤④的操作是将注射器4稍稍向外拉,其目的是检验瓶内二氧化碳是否完全反应。
故填:将注射器4稍稍向外拉;检验瓶内二氧化碳是否完全反应。
(4)步骤⑤中,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,观察到溶液变浑浊,反应方程式:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。
故填:溶液变浑浊;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。

 阅读快车系列答案
阅读快车系列答案