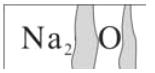
��Ŀ����
����Ŀ������ϡ���ᡢϡ���ᡢBa��OH��2��Һ��Na2CO3��Һ��NaCl��Һ��ƿ�ޱ�ǩ����Һʱ��������������ΪA��B��C��D��E���������ʵ�飺

��1����������ʵ����̣�ȷ��C��Һ��_____��B��E���ʱ������Ϊ_____��
��2���������������ʻ�ϵ���ͬһ�ձ��У����ֻ����ʻ���״�����˺���Һ�ʺ�ɫ��˵����Һ��_____�ԣ��������ijɷ���_____��
��3��Ϊ�˷�ֹ��Һ��Ⱦ����������Һ����μ��������Na2CO3��Һʱ�������������ݲ��������а�ɫ�������ɡ��ۺ�����ʵ������жϣ�����Na2CO3��Һǰ����Һ�к��е����ʳ�ʯ���⣬һ������_____��
���𰸡�ϡ���� �����ݲ��� �� ���ᱵ �Ȼ��⡢�Ȼ������Ȼ��ơ���
��������
�ֱ�ȡ������Һ�μ�ʯ����Һ��A����ʹʯ����Һ��ɫ�������Ե��Ȼ�����Һ�����A���Ȼ��ƣ�B��C��ʹʯ����Һ��ɺ�ɫ����������Һ�����B��C�ֱ���ϡ���ᡢϡ�����е�һ�֣�D��E��ʹʯ����Һ�����ɫ���Ǽ�����Һ�����D��E�ֱ�������������̼�����е�һ�֣�B��C��D��E��Һ������ϣ�B��D�ܹ�������������Ϊ�����ܺ�����������Ӧ�������ᱵ���������B�����ᣬD��������������A�����ᣬE��̼���ƣ���ˣ�
��1����������ʵ�����ȷ��C��Һ�����ᣬB��ϡ���ᣬE��̼���ƣ����߷�Ӧ����������̼���壻�ʴ�Ϊ��ϡ��������ݲ�����
��2�����˺���Һ�ʺ�ɫ��˵����Һ�����ԣ���Ϊ��ҺΪ���ԣ�����ϡ�����ϡ�����ʣ�࣬��������ij���Ӧ�������������������Ӧ���������ᱵ�������������ᱵ��
��3����Ϊ��ҺΪ���ԣ�����ϡ�����ϡ�����ʣ�࣬���̼�����ܹ���Ӧ����������̼�����ȡ������Һ����������μ��������Na2CO3��Һ���ܹ��Ȳ������ݺ��������������Ӧ����̼���ƺ��Ȼ�����Ӧ�����ģ������Һ��һ�������Ȼ���������Һ����������ʣ�࣬�������Ե���ϡ���ᣬ������Ȼ��ƣ��ʴ�Ϊ���Ȼ��⡢�Ȼ������Ȼ��ơ�