题目内容
【题目】2019年为“元素周期表年”,元素周期表是学习和研究化学的重要工具。
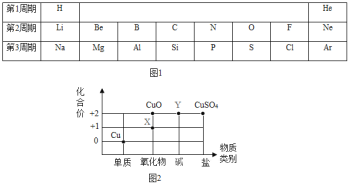
(1)原子序数为1~18的元素在元素周期表中的位置如下表所示(图1):
①Al属于______(填“金属”或“非金属”)元素,其原子的核电荷数为____。
②Na原子的结构示意图为![]() ,则钠离子的核外电子数为____。
,则钠离子的核外电子数为____。
③周期表中磷元素的有关信息为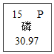 ,图中“30.97”所表示的含义是________。
,图中“30.97”所表示的含义是________。
(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价-物质类别”关系图(图2)。
①写出物质X的化学式:____。
②写出由物质Y转化为CuSO4的化学反应方程式:_______。
【答案】金属 13 10 磷原子的相对原子质量为30.97 Cu2O ![]()
【解析】
(1)①Al的元素名称为铝,由“金”字旁可知,属于金属元素,铝原子的原子序数为13,根据原子序数=质子数=核电荷数=原子的核外电子数,所以铝原子的核电荷数为13;
②Na原子的结构示意图为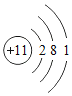 ,最外层电子数为1,小于4个,易失去最外层电子数,则钠离子的核外电子数为10;
,最外层电子数为1,小于4个,易失去最外层电子数,则钠离子的核外电子数为10;
③周期表中磷元素的有关信息为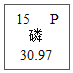 ,图中“30.97”所表示的含义是磷原子的相对原子质量为30.97;
,图中“30.97”所表示的含义是磷原子的相对原子质量为30.97;
(2)①X属于氧化物,且X中铜元素的化合价为+1价,氧元素的化合价为-2价,物质X的化学式为:Cu2O;
②根据题意可知:Y属于碱,且Y中铜元素的化合价是+2价,故Y是氢氧化铜,由物质Y转化为CuSO4的化学反应方程式为:Cu(OH)2+H2SO4=CuSO4+2H2O;
答案:
(1)①金属;13;②10;③磷原子的相对原子质量为30.97;
(2)①Cu2O②Cu(OH)2+H2SO4=CuSO4+2H2O。

 培优好卷单元加期末卷系列答案
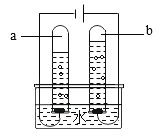
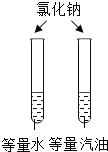
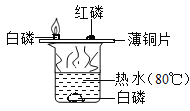
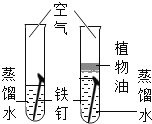
培优好卷单元加期末卷系列答案【题目】设计对比实验,控制变量是学习化学的重要方法,下列对比实验不能达到目的的是
编号 | ① | ② | ③ | ④ |
实验设计 |
|
|
|
|
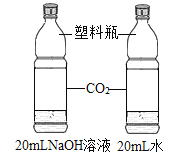
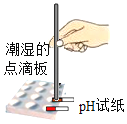
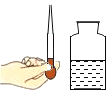
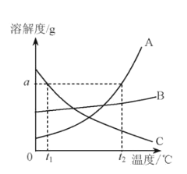
实验目的 | 探究同种物质在不同溶剂中的溶解性 | 探究可燃物燃烧的条件 | 探究铁生锈的条件 | 探究CO2与NaOH溶液能否发生反应 |
A.AB.BC.CD.D
【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后瓶中残留废液进行探究。
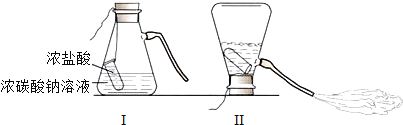
(提出问题)废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质是NaCl、Na2CO3和HCl
猜想2:废液中的溶质只有NaCl
猜想3:废液中的溶质是NaCl、HCl
猜想4:废液中的溶质是_____
(讨论与交流)
小明认为猜想1无需验证就知道是错误的,他的理由是___(请用化学方程式说明)。
(实验与结论)
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。你认为他的结论_____(填“正确”或“错误”),理由是__。
(2)请你另设计实验方案验证猜想3:
实验步骤 | 实验现象 | 实验结论 |
_____ | _____ | 猜想3正确 |
(3)欲从猜想3的废液中得到纯净的NaCl晶体,请设计合理的实验方案_____。