题目内容
【题目】合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。一般来说,合金的熔点低于任何一种组成金属的熔点。下表是一些金属的熔点数据:
金属 | 铜 | 锌 | 锡 | 铅 | 铋 | 镉 |
熔点/°C | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
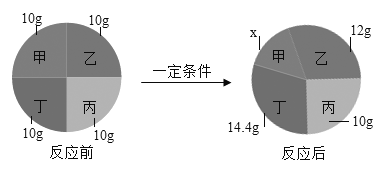
(1)铅锡合金中某种金属的质量分数与合金的熔点有如图所示的关系,其中横坐标表示的是____________(填物质名称)的质量分数;当合金熔点最低时,合金中铅与锡的质量比为_______________。

(2)保险丝由铋、铅、锡、镉组成,其熔点约为_____________。
A 15~30 °C
B 60~80 °C
C 235~250° C
D 300~320°C
【答案】锡 2:3 B
【解析】
(1)横坐标质量分数为零时熔点要比质量分数为1时熔点高,因为铅的熔点比锡的熔点高,所以横坐标表示锡的质量分数;合金熔点最低时锡占60%,所以铅占40%,合金中铅与锡的质量比为:40%:60%=2:3;
(2)合金的熔点比它的组成成分熔点要低,铋、铅、锡、镉这四种物质熔点最低的是231.9,所以要选择熔点比231.9低,且不能很低,必须要高于室温,故选:B。
故答案为:(1)锡;2:3;(2)B。

 走进文言文系列答案
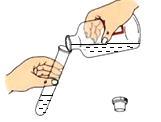
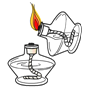
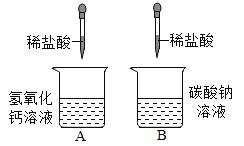
走进文言文系列答案【题目】某校化学兴趣小组的同学进行了如图所示的A、B两个实验,充分反应后将A、B烧杯内的物质混合,观察不到明显现象。同学们决定对最终混合溶液中含有哪些溶质进行实验探究,请你一同参与其中。
(交流讨论)
同学们经过讨论后一致认为:最终混合溶液中溶质肯定含有氯化钠和氯化钙。
(提出问题)
混合溶液中除了氯化钠和氯化钙,还有什么溶质?
(猜想假设)
甲同学的猜想:只有氯化钠、氯化钙;
乙同学的猜想:除了氯化钠和氯化钙,还有氯化氢;
丙同学的猜想:除了氯化钠和氯化钙,还有______。
(设计实验)甲、乙、丙三位同学分别设计了不同的实验来验证猜想。
实验操作 | 实验现象 | 实验结论 |
甲同学:取少量混合溶液于试管中,滴加紫色石蕊溶液 | ________ | 乙同学的 猜想正确 |
乙同学:取少量混合溶液于试管中,加入___。 | ______ | |
丙同学:取少量混合溶液于试管中,逐滴加入Na2CO3溶液至过量 | 开始有气泡产生,过一会出现白色沉淀 |
(反思评价)
(1)丙同学的实验中开始有气泡产生,过一会出现白色沉淀的原因是_________________。
(2)丁同学认为加入无色酚酞溶液也可以证明乙同学的猜想正确,其他同学不同意他的观点,原因是。______________