��Ŀ����
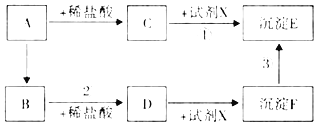
����Ŀ��ijУ��ѧ��ȤС���ͬѧ��������ͼ��ʾ��A��B����ʵ�飬��ַ�Ӧ��A��B�ձ��ڵ����ʻ�ϣ��۲첻����������ͬѧ�Ǿ��������ջ����Һ�к�����Щ���ʽ���ʵ��̽��������һͬ�������С�
���������ۣ�
ͬѧ�Ǿ������ۺ�һ����Ϊ�����ջ����Һ�����ʿ϶������Ȼ��ƺ��Ȼ��ơ�
��������⣩
�����Һ�г����Ȼ��ƺ��Ȼ��ƣ�����ʲô���ʣ�
��������裩
��ͬѧ�IJ��룺ֻ���Ȼ��ơ��Ȼ��ƣ�
��ͬѧ�IJ��룺�����Ȼ��ƺ��Ȼ��ƣ������Ȼ��⣻
��ͬѧ�IJ��룺�����Ȼ��ƺ��Ȼ��ƣ�����______��
�����ʵ�飩�ס��ҡ�����λͬѧ�ֱ�����˲�ͬ��ʵ������֤���롣
ʵ����� | ʵ������ | ʵ����� |
��ͬѧ��ȡ���������Һ���Թ��У��μ���ɫʯ����Һ | ________ | ��ͬѧ�� ������ȷ |
��ͬѧ��ȡ���������Һ���Թ��У�����___�� | ______ | |
��ͬѧ��ȡ���������Һ���Թ��У���μ���Na2CO3��Һ������ | ��ʼ�����ݲ�������һ����ְ�ɫ���� |
����˼���ۣ�
(1)��ͬѧ��ʵ���п�ʼ�����ݲ�������һ����ְ�ɫ������ԭ����_________________��
(2)��ͬѧ��Ϊ������ɫ��̪��ҺҲ����֤����ͬѧ�IJ�����ȷ������ͬѧ��ͬ�����Ĺ۵㣬ԭ���ǡ�______________
���𰸡��������� ��Һ��Ϊ��ɫ ����(����������ĩ�Ⱥ�������) �����ݲ�������Һ����ɫ��Ϊdz��ɫ(�����ɫ�����ܽ⣬��Һ����ɫ��Ϊ��ɫ�Ⱥ������ɣ�����һ�ն�Ӧ) �����Һ�������ᣬ̼������Һ�Ⱥ����ᷴӦ�������ᷴӦ��ȫ��̼������Һ�ٺ��Ȼ�����Һ��Ӧ����̼��ư�ɫ���� ��ɫ��̪��Һ�����Ժ�������Һ�ж�����ɫ
��������
������裺
�ɡ���ַ�Ӧ��A��B�ձ��ڵ����ʻ�ϣ��۲첻����������֪�����ջ����Һ�г����������Ȼ��ƺ��Ȼ����⣬һ������̼���ƣ����ܺ����Ȼ�����������ƣ����ͬѧ�IJ���Ϊ�����Ȼ��ƺ��Ȼ����⣬�����������ơ�
���ʵ�飺
����ʵ����ۡ���ͬѧ�IJ�����ȷ��֪�������Һ���������Ȼ��⣬��˿ɸ������������ѡ���Լ�������֤�����Լ�����˳��λ����ǰ�Ľ�������������ۺ��������ᷴӦ�����Ȼ��������������۲쵽�����ݲ�������Һ����ɫ��Ϊdz��ɫ��Ҳ�ɼ������������������������ĩ�������������ᷴӦ�����Ȼ�����ˮ���۲쵽����ɫ�����ܽ⣬��Һ����ɫ��Ϊ��ɫ�����У���
ʵ����� | ʵ������ | ʵ����� |
��ͬѧ��ȡ���������Һ���Թ��У��μ���ɫʯ����Һ | ��Һ��Ϊ��ɫ | ��ͬѧ�� ������ȷ |
��ͬѧ��ȡ���������Һ���Թ��У���������(����������ĩ�Ⱥ�������)�� | �����ݲ�������Һ����ɫ��Ϊdz��ɫ(�����ɫ�����ܽ⣬��Һ����ɫ��Ϊ��ɫ�Ⱥ������ɣ�����һ�ն�Ӧ) | |
��ͬѧ��ȡ���������Һ���Թ��У���μ���Na2CO3��Һ������ | ��ʼ�����ݲ�������һ����ְ�ɫ���� |
��˼���ۣ�
(1)��ͬѧ��ʵ���п�ʼ�����ݲ�������һ����ְ�ɫ������ԭ���ǻ����Һ�������ᣬ̼������Һ�Ⱥ����ᷴӦ�������ᷴӦ��ȫ��̼������Һ�ٺ��Ȼ�����Һ��Ӧ����̼��ư�ɫ������
(2)���ڷ�̪��Һ�����Ժ�������Һ�ж�����ɫ�����������Һ�м�����ɫ��̪��Һ����֤����ͬѧ�IJ�����ȷ��

����Ŀ����һ��ʵ����ϣ�ij��ȤС���ʵ������ȡ������̼չ����̽����
��1�����±�����ʵ�飬ȡ�������Ĵ���ʯ�����������У����ʲ����ᷴӦ����������CO2�����ʱ��仯��������ͼ��ʾ��
ʵ���� | ҩƷ |
�� | ��״����ʯ��10%ϡ���� |
�� | ��״����ʯ��7%ϡ���� |
�� | ����ʯ��ĩ��7%ϡ���� |
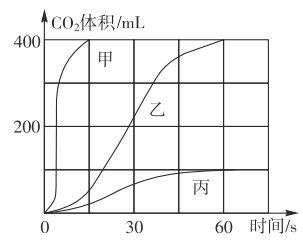
ͼ�б���Ӧʵ��______����ʵ���ţ����Աȼ��ҿ��Կ�����Ӱ�컯ѧ��Ӧ����������֮һ��______��ȷ�����Ҷ�Ӧ��ҩƷ��ȡ������̼����Ӧ�Ļ�ѧ����ʽΪ______��
��2�����Ҷ�Ӧ��ҩƷ��ȡ������̼�����۲첻�����ݲ���ʱ���ֹ�������ʣ�࣬С���Դ�չ��̽�������ʲ�����ˮ�Ҳ����ᷴӦ����
��������⣩���ٲ������ݵ�ԭ����ʲô��
���������ϣ���ɫʯ����һ�����ָʾ������������Һ�л��ɺ�ɫ����������Һ�в���ɫ���Ȼ�����Һ�����ԡ�
���������룩����һ����Ӧ����Һ�������
�������ʣ���������̼��ơ�
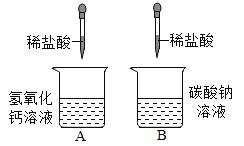
��ʵ��̽��һ����Ӧ����Һ���Ƿ������
��С��ȡ������Ӧ�����Һ���μ���ɫʯ��۲쵽______��˵����Ӧ����Һ��______�ԣ��ɴ˵ó�����һ��������
��С����ΪС����ʵ�鲻�Ͻ�����Ӧ�������������Һ����Ե�Ӱ�죬���Dz�������������ʵ�飺
ʵ��A������______�����������ƻ�ѧʽ����Һ�����μ���ɫʯ����Һ����Һ����ɫ��ʵ��B�����Թ��м�������ˮ����ɫʯ����Һ������ͨ��CO2����Һ��Ϊ______ɫ��
��С����ΪС����ʵ��Ҳ�����Ͻ������ٴθĽ�ʵ�飬���յó���ȷ�Ľ��ۣ���Ӧ�����Һ�������ᣬ����һ��������
��ע�⣺���������С�⽱��4�֣���ѧ�Ծ��ֲܷ�����60�֡���
��ʵ��̽�����������ʵ�飬̽����Ӧ���ʣ��������Ƿ���̼��ƣ�
ʵ�鲽�� | ʵ������ | ʵ����� |
_____ | ______ | ______ |
����Ŀ���Ͻ��������ֻ��������ϵĽ���(�������ǽ���)�ۺ϶��ɵľ��н������Ե����ʡ�һ����˵���Ͻ���۵�����κ�һ����ɽ������۵㡣�±���һЩ�������۵�����:
���� | ͭ | п | �� | Ǧ | �� | �� |
�۵�/��C | 1083 | 419.6 | 231.9 | 327.5 | 271.3 | 320.9 |
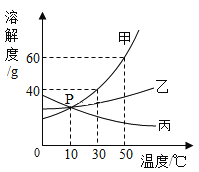
(1)Ǧ���Ͻ���ij�ֽ���������������Ͻ���۵�����ͼ��ʾ�Ĺ�ϵ,���к������ʾ����____________(����������)����������;���Ͻ��۵����ʱ���Ͻ���Ǧ������������Ϊ_______________��

(2)����˿���顢Ǧ�����������,���۵�ԼΪ_____________��
A 15~30 ��C
B 60~80 ��C
C 235~250�� C
D 300~320��C