题目内容
【题目】学习完本单元的实验活动后,化学实验小组成员一起来解决下列问题:
(1)小红同学从某一歉收农田里取回一份土壤样品,如果检测结果呈酸性,从经济和可行性方面考虑,如果要改良此土壤的酸性,应向农田里施用________(填俗名)。
(2)小明同学用如图总结了NaOH的四条化学性质(NaOH与四类物质能够发生化学反应)。
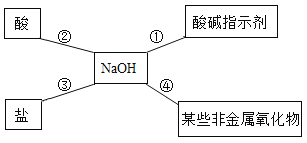
Ⅰ.为了验证反应①和反应②,小红将无色酚酞试液滴入NaOH溶液中,溶液由无色变成________;接着往其中滴入稀硫酸,边滴加边振荡,又发现溶液的颜色______________,后者变色原因可用化学方程式表示为__________________。
Ⅱ.依据反应④说明NaOH必须密封保存,否则在空气中容易发生变质,其反应的化学方程式为____________。
Ⅲ.为了验证反应③能够发生,你选择的物质是__________ (填字母)。
A Na2CO3 B HCl C CuSO4 D SO3
【答案】熟石灰 红色 由红色变为无色 2NaOH+H2SO4=Na2SO4+2H2O 2NaOH+CO2=Na2CO3+H2O C
【解析】
(1)改良酸性土壤,应向农田里施用熟石灰。
(2)Ⅰ.NaOH溶液显碱性,无色酚酞试液遇NaOH溶液,由无色变成红色;接着往其中滴入稀硫酸,边滴加边振荡,又发现溶液的颜色由红色变为无色,后者变色原因是氢氧化钠与稀硫酸发生反应,溶液不显碱性了,化学方程式为:2NaOH+H2SO4=Na2SO4+2H2O。
Ⅱ.NaOH能与空气中的二氧化碳反应,反应的化学方程式为:2NaOH+CO2=Na2CO3+H2O,故NaOH必须密封保存。
Ⅲ. 反应③是碱与盐的反应,碱与盐反应时,必须是可溶性碱与可溶性盐反应,且生成物中有沉淀;
A Na2CO3不与氢氧化钠反应,此选项不符合题意;
B HCl不属于盐,属于酸,此选项不符合题意;
C CuSO4能与氢氧化钠反应,生成氢氧化铜蓝色沉淀,此选项符合题意;
D SO3不属于盐,属于氧化物,此选项不符合题意。故选C。