题目内容
【题目】“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气 等。化学兴 趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如下图所示。同学们 对这包久置的“双吸剂”固体 样品很好奇,设计实验进行探究。

(提出问题)久置“双吸剂”固体的成分是什么?
(查阅资料)
①铁与氯化铁溶液在常温下反应生成氯化亚铁:Fe+2FeCl3=3FeCl2;
②碱性的 Na2CO3溶液可以与中性的 CaCl2 溶液发生复分解反应。
(作出猜想)久置固体中可能含有 Fe、Fe2O3、CaO、Ca(OH)2 和 CaCO3。
(定性研究)小明取少量样品放入试管中,加入一定量的稀盐酸,发现,试管中固体质量逐渐减少,生成一种 能使澄清石灰水变浑浊的气体,得到浅绿色溶液,他初步判断:样品中一定含有_____,一定不含 Fe2O3。
(实验质疑)小组同学谈论认为上述实验并不能得出一定不含 Fe2O3的结论,理由是_____,(用化学方程式表示)。为进一步确定这包久置的“双吸剂”固体的成分进行如下定量实验。
(定量研究)取 3g 样品研碎,并用磁铁充分吸引后,得到剩余固体 2. 6g,按照如图流程进行实验,请回答相 关问题:
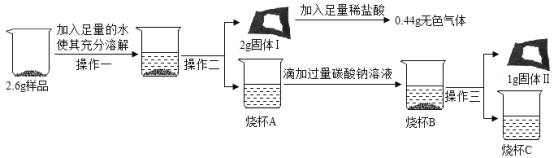
(1)操作二、操作三名称是_________________________。
(2)固体 I 的成分是_______________________。(填物质化学式,下同);
(3)写出生成固体Ⅱ的化学方程式_______________________。
(4)根据定性、定量研究中现象的分析及有关数据计算判断,这包久置“双吸剂”固体的成分中氧化钙的质量小于__________________。
(实验反思)结合上面的实验,下列说法正确的是______________________(填字母序号)
A对物质成分的研究有时需要定性和定量相结合
B在原样品中加入足量盐酸有 4 个反应发生
C定量研究烧杯 C 中的溶质为 NaOH 和 Na2CO3
【答案】CaCO3、Fe Fe2O3+6HCl=2FeCl3+3H2O;Fe+2FeCl3=3FeCl2 过滤 CaCO3、Fe2O3 Na2CO3+Ca(OH)2=2NaOH+CaCO3↓ 0.56g AC
【解析】
定性研究:小明取少量样品放入试管中,加入一定量的稀盐酸,发现,试管中固体质量逐渐减少,生成一种能使澄清石灰水变浑浊的气体,二氧化碳气体能使石灰水变浑浊,则样品中一定含有碳酸钙,碳酸钙与稀盐酸反应原理:CaCO3+2HCl=CaCl2+H2O+CO2↑;稀盐酸与铁反应得到浅绿色氯化亚铁溶液和氢气,反应原理为:Fe+2HCl=FeCl2+H2↑,初步判断:样品中一定含有:CaCO3和Fe,一定不含 Fe2O3。
实验质疑:小组同学谈论认为上述实验并不能得出一定不含 Fe2O3的结论,理由是:盐酸与氧化铁反应生成棕黄色氯化铁溶液和水,反应原理为:Fe2O3+6HCl=2FeCl3+3H2O,氯化铁溶液可以继续和铁反应生成氯化亚铁溶液:Fe+2FeCl3=3FeCl2,所得氯化亚铁溶液依然为浅绿色;
(1)操作二、操作三都是分离不溶性固体和液体,操作名称为:过滤;
(2)固体 I 的成分是;CaCO3和Fe2O3;因为2g固体中加入足量盐酸生成0.44g气体,
若生成的0.44g气体全部为二氧化碳,设:碳酸钙的质量为x,
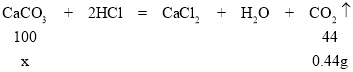
![]() x=1g,小于固体质量Ⅰ中的2g,则固体中不止含有碳酸钙,还有氧化铁固体;
x=1g,小于固体质量Ⅰ中的2g,则固体中不止含有碳酸钙,还有氧化铁固体;
(3)烧杯A中只有氢氧化钙溶液,加入足量的碳酸钠溶液,氢氧化钙与碳酸钠反应原理为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓;
(4)根据定性、定量研究中现象的分析及有关数据计算判断,这包久置“双吸剂”固体的成分中氧化钙的质量小于0.56g:因为固体Ⅱ中碳酸钙的质量为1g,则碳酸钙中钙元素质量为1g×![]() ×100%=0.4g,假设这些钙元素全部由氧化钙提供,则需要氧化钙的质量为0.56g,而固体溶于水减少的质量是0.6g>0.56g,所以样品中一定还含有氢氧化钙,所以氧化钙的质量一定小于0.56g;
×100%=0.4g,假设这些钙元素全部由氧化钙提供,则需要氧化钙的质量为0.56g,而固体溶于水减少的质量是0.6g>0.56g,所以样品中一定还含有氢氧化钙,所以氧化钙的质量一定小于0.56g;
实验反思:
A、对物质成分的研究有时需要定性和定量相结合,此说法正确;
B、根据定性研究并结合以上分析可知:在原样品中加入足量盐酸,存在的5种物质有碳酸钙、铁、氧化铁、氧化钙、氢氧化钙,都能和稀盐酸反应生反应,至少能发生5种化学反应:①CaCO3+2HCl=CaCl2+H2O+CO2↑;② Fe+2HCl=FeCl2+H2↑;③Fe2O3+6HCl=2FeCl3+3H2O;④CaO+2HCl=CaCl2+H2O;⑤Ca(OH)2+2HCl=CaCl2+2H2O
C、定量研究烧杯 C 中的溶质为 NaOH 和 Na2CO3,此说法正确;烧杯中有过量的碳酸钠溶液,碳酸钠与氢氧化钙溶液反应后悔产生氢氧化钠溶液和碳酸钙沉淀,其反应原理为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
结合上面的实验,说法正确的是AC。

 名校课堂系列答案
名校课堂系列答案