题目内容
【题目】在研究酸和碱的化学性质时,同学们想证明:稀H2SO4与NaOH溶液确实发生了反应。请你与他们一起完成实验方案设计、实施和评价。(注:硫酸钠溶液呈中性)
(1)向NaOH溶液中滴入2~3滴酚酞溶液,溶液由无色变为__________色。
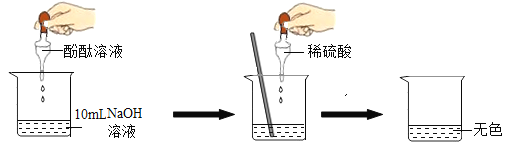
(2)根据上述实验中颜色变化,确定稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为____________。
(3)因为溶液变成了无色,小林说“稀硫酸一定过量了”,小林这么说的理由是_____________。
(4)为确定小林的说法是否正确,同学们又设计了下列实验方案并进行实验:
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 稀H2SO4过量 |
方案二一 | 取样,滴入2-3滴紫色石蕊溶液 | 溶液变成红色 | 稀H2SO4过量 |
上述方案中,你认为正确的是____________(填“方案一”或“方案二”)。另外一个实验方案错误的原因(用化学方程式表示): ______________。请你再设计一种实验方案确定稀H2SO4过量,你选用___________(填药品)。
【答案】红 H2SO4+2NaOH=Na2SO4+2H2O 酸溶液不能使酚酞溶液变色 方案二 Na2SO4+BaCl2=BaSO4↓+2NaCl 锌粒(合理即可)
【解析】
(1)向NaOH溶液(显碱性)中滴入2~3滴酚酞溶液(酚酞遇碱性溶液变红)由无色变为红_色。
(2)稀硫酸与氢氧化钠溶液反应产生硫酸钠溶液和水的化学方程式为 H2SO4+2NaOH=Na2SO4+2H2O。
(3)因为溶液变成了无色,小林说“稀硫酸一定过量了”,小林这么说的理由是:酸溶液不能使酚酞溶液变色;
(4)正确的是方案二。方案一错误的原因是:硫酸钠与氯化钡反应也能产生硫酸钡沉淀和氯化钠:Na2SO4+BaCl2=BaSO4↓+2NaCl。
设计一种实验方案确定稀H2SO4过量,加入适量锌,锌与稀硫酸反应产生硫酸锌和气体,若有气泡产生,则说明硫酸过量,反之,则没有。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案