题目内容
【题目】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】(1)草酸晶体(H2C2O43H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O43H2O ![]() CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
【问题讨论】为了测定铁红中铁的质量分数,小组间进行如下实验。(装置气密性良好)
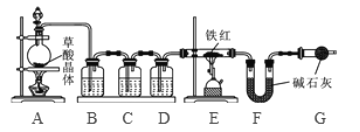
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是________(填字母序号)
a.浓硫酸 b.澄清的石灰水 c氢氧化钠溶液
(2)C装置的作用是 __________________________。
(3)写出E装置中所发生反应的一个化学方程式: _____________________。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则 ____ < m < ______。
②若实验前后称得F装置増重7.7g,则此铁红中铁的质量分数是 _________。
【实验反思】 (1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会 ________(选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是 ___________________。
【答案】 cba 检验二氧化碳气体是否除尽 3CO+Fe2O3![]() 2Fe+3CO2或 4CO+Fe3O4
2Fe+3CO2或 4CO+Fe3O4![]() 3Fe+4CO2或CO+FeO
3Fe+4CO2或CO+FeO![]() Fe+CO2 7.0 7.78 72% 偏小 缺少尾气处理装置
Fe+CO2 7.0 7.78 72% 偏小 缺少尾气处理装置
【解析】(1)除去二氧化碳用氢氧化钠溶液、检验二氧化碳用澄清石灰水,除去水蒸气用浓硫酸。(2)C装置的作用是检验二氧化碳气体是否除尽。(3)E装置中所发生反应的化学方程式是:3CO+Fe2O3![]() 2Fe+3CO2或 4CO+Fe3O4
2Fe+3CO2或 4CO+Fe3O4![]() 3Fe+4CO2或CO+FeO
3Fe+4CO2或CO+FeO![]() Fe+CO2 (4)①FeO中铁的质量分数为77.8%、Fe2O3中铁的质量分数为70.0%、Fe3O4中铁的质量分数为72.4%,所以10g铁红样品充分反应后得到铁粉的质量m为:10g×70.0%=7g<m<10g×77.8%=7.78g。②F装置増加的质量是生成二氧化碳的质量,二氧化碳中的氧元素一般来自铁红,所以铁红中氧元素的质量为:7.7g×
Fe+CO2 (4)①FeO中铁的质量分数为77.8%、Fe2O3中铁的质量分数为70.0%、Fe3O4中铁的质量分数为72.4%,所以10g铁红样品充分反应后得到铁粉的质量m为:10g×70.0%=7g<m<10g×77.8%=7.78g。②F装置増加的质量是生成二氧化碳的质量,二氧化碳中的氧元素一般来自铁红,所以铁红中氧元素的质量为:7.7g×![]() ×
×![]() =2.8g,则铁红中铁元素的质量分数为:
=2.8g,则铁红中铁元素的质量分数为:![]() ×100%=72%【实验反思】 (1)如果缺少G装置,则空气中的二氧化碳和水蒸气进入装置F中,测得二氧化碳的质量偏大,铁红中氧元素的质量分数偏大,铁元素的质量分数偏小。(2)该实验的尾气中含有有毒的一氧化碳,缺少尾气处理装置。
×100%=72%【实验反思】 (1)如果缺少G装置,则空气中的二氧化碳和水蒸气进入装置F中,测得二氧化碳的质量偏大,铁红中氧元素的质量分数偏大,铁元素的质量分数偏小。(2)该实验的尾气中含有有毒的一氧化碳,缺少尾气处理装置。

【题目】某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。
【提出问题】①三种溶液的酸碱性?
②它们与酸反应时溶液的pH如何变化?
【查阅资料】
pH | 2~3 | 4~6 | 7 | 8~9 | 10~11 | 12~14 |
紫甘蓝汁液显示的颜色 | 紫红 | 浅紫 | 紫色 | 蓝色 | 绿色 | 黄色 |
【实验1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 紫色 | 蓝色 | 绿色 | 黄色 |
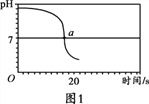
【实验2】向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
【实验3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。

【解释与结论】
(1)实验1得出三种溶液的碱性由强到弱的顺序为________________。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是_________,实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是_________。
(3)实验3中,b点的溶质为_________,c点后发生反应的化学方程式为_________。
(4)依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体的实验方案为_________。