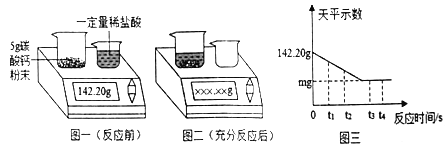
题目内容
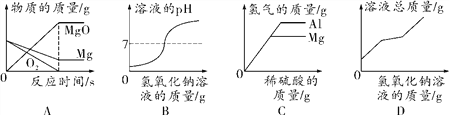
【题目】下列图象分别与选项中的操作相对应,其中不合理的是

A. 向一定量的饱和石灰水中加入生石灰
B. 向硝酸钡和氢氧化钾的混合溶液中滴加稀硫酸
C. 向一定量氯化钙和盐酸的混合溶液中滴加碳酸钠溶液
D. 向一定量的硝酸银、硝酸铝和硝酸铜的混合溶液中加入锌粉
【答案】A
【解析】A、向一定量饱和澄清石灰水中加入少量生石灰,生石灰与水反应生成氢氧化钙,导致溶液中的溶剂减少,溶液中溶质质量最终将会减少,错误;B、硝酸钡和硫酸反应生成不溶于水的硫酸钡沉淀,一开始就会出现沉淀,正确;C、向一定量的盐酸和氯化钙混合溶液中滴加碳酸钠溶液,碳酸钠会先与盐酸反应,然后在与氯化钙反应,所以溶液的pH先增大,然后不变,完全反应后,pH继续增大,正确;D、四种金属的活动性顺序是:铝、锌、铜、银,所以向一定量的硝酸银、硝酸铜和硝酸铝的混合溶液中加入Zn,锌会先与硝酸银反应,发生的反应是锌和硝酸银反应生成硝酸锌和银,每65份质量的锌能析出216份质量的银,开始时溶液质量减小;然后再与硝酸铜反应,每65份质量的锌能析出64份质量的铜,溶液质量增加,完全反应后溶液的质量不变。正确。故选A。

 阅读快车系列答案
阅读快车系列答案【题目】某化学实验小组要测定一种纯碱样品中碳酸钠的含量,并用一定溶质质量分数的稀硫酸进行实验,记录实验数据如下(样品中杂质不含钠元素、不溶于水也不与硫酸反应)
第一次 | 第二次 | 第三次 | |
加入的稀硫酸的质量(g) | 100 | 100 | 100 |
加入的样品的质量(g) | 20 | 40 | 42 |
生成气体的质量(g) | 2.2 | a | 4.4 |
(1)上表中a=_________;
(2)根据已知条件列出求解第三次参加反应的纯碱的质量(x)的比例式__________;
(3)将第二次实验所得的溶液蒸发掉6.2g水,所得不饱和溶液中溶质的质量分数为___________;
(4)若配制实验中所用稀硫酸200g,需要用溶质质量分数为98%的浓硫酸的质量为________;
(5)这种纯碱样品中碳酸钠的质量分数为______________。
【题目】某小组同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行探究。
【提出问题】①三种溶液的酸碱性?
②它们与酸反应时溶液的pH如何变化?
【查阅资料】
pH | 2~3 | 4~6 | 7 | 8~9 | 10~11 | 12~14 |
紫甘蓝汁液显示的颜色 | 紫红 | 浅紫 | 紫色 | 蓝色 | 绿色 | 黄色 |
【实验1】向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
液体名称 | 蒸馏水 | 碳酸氢钠溶液 | 碳酸钠溶液 | 氢氧化钠溶液 |
紫甘蓝汁液显示的颜色 | 紫色 | 蓝色 | 绿色 | 黄色 |
【实验2】向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图1所示。
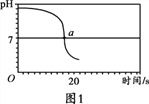
【实验3】向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,测得pH变化与时间的关系如图2、图3所示。将图2与图3的阴影部分进行叠加,发现两者基本重合。

【解释与结论】
(1)实验1得出三种溶液的碱性由强到弱的顺序为________________。
(2)实验2证明了氢氧化钠能与盐酸发生反应,其理由是_________,实验结束,向反应后的溶液中滴加紫甘蓝汁液,观察到的现象是_________。
(3)实验3中,b点的溶质为_________,c点后发生反应的化学方程式为_________。
(4)依据实验3获取的信息,鉴别Na2CO3和NaHCO3固体的实验方案为_________。