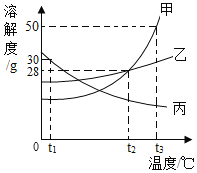
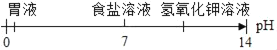
题目内容
【题目】已知复分解反应![]() 可进行。在常温下,测得相同浓度的下列六种溶液的pH:表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性弱的物质。依照该规律,请你判断下列反应不能成立的是
可进行。在常温下,测得相同浓度的下列六种溶液的pH:表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性弱的物质。依照该规律,请你判断下列反应不能成立的是
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 8.6 | 11.6 | 10.3 | 11.1 |
A.![]()
B.![]()
C.![]()
D.![]()
【答案】C
【解析】
通过分析,规律是强碱制弱碱。
在碱性溶液中,pH越大,碱性越强;pH越小,碱性越弱。
A、由表可知,NaCN溶液的pH=11.1,CH3COONa溶液的pH=8.8。前者的碱性大于后者,所以该反应属于“强碱制弱碱”,可以发生。A正确;
B、由表可知,NaClO溶液的pH=10.3,NaHCO3溶液的pH=8.6。前者的碱性大于后者,所以该反应属于“强碱制弱碱”,可以发生。B正确;
C、由表可知,NaClO溶液的pH=10.3,Na2CO3溶液的pH=11.6。前者的碱性小于后者,所以该反应属于“弱碱制强碱”,不能发生。C错误;
D、由表可知,NaClO溶液的pH=10.3,CH3COONa溶液的pH=8.8。前者的碱性大于后者,所以该反应属于“强碱制弱碱”,可以发生。D正确。
故选C。

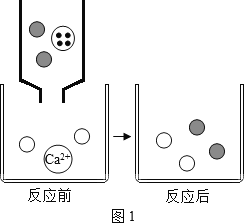
【题目】在探究氢氧化钙与稀盐酸中和反应实验时,忘记了滴加酚酞溶液,无法判断反应进行到何种程度,同学们决定对反应后溶液中溶质的成分进行探究。
请写出该反应的化学方程式。_____
(提出问题)反应后溶液中的溶质是什么?
(做出猜想)猜想一:CaCl2 和 Ca(OH)2 猜想二:CaCl2 和 HCl猜想三:_____
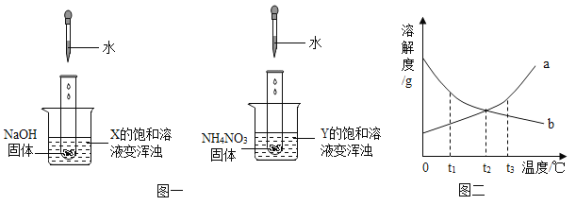
(设计方案)
实验操作 | 实验现象 | 实验结论 |
①取少量反应后的溶液于试管中,滴加酚酞试液 | _____。 | 猜想一不正确 |
②另取少量反应后的溶液于试管中,加入_____。 | _____。 | 猜想二不正确 |
(拓展与应用)将稀盐酸逐滴匀速加入一定量的稀氢氧化钙溶液中,用数字化仪器对反应过程中溶液的温度、pH 进行实时测定,得到的曲线如图 1、图2所示。
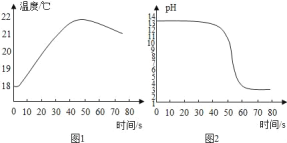
由图 1、图2知,稀盐酸与稀氢氧化钙溶液已发生中和反应的判断依据是_____。