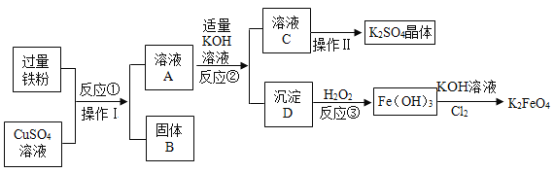
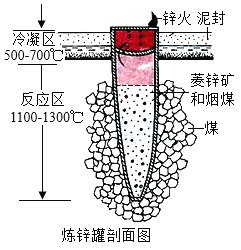
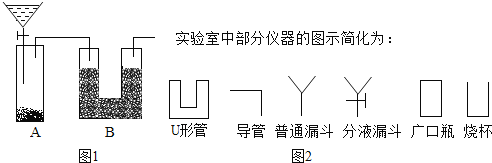
��Ŀ����
����Ŀ����ͼ�Ǽס��ҡ������ֹ������ʣ������ᾧˮ�����ܽ�����ߡ���ش��������⡣
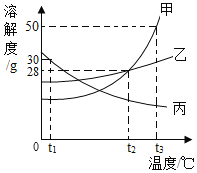
��1��t2��ʱ��______���ܽ����ȡ�
��2��t3��ʱ50g����50gˮ�г���ܽ��������Һ��______����������������������������Һ������Һ���������ܼ���������Ϊ______��
��3�������ı�����Һ��t3�潵�µ�t2�棬һ���ᷢ���ı����______������ĸ����
A �ܽ��B ���ʵ�����C ���ʵ���������
��4���ֱ��ҡ����������ʵı�����Һ��100g��t3�潵��t1�棬���º��ҡ���������Һ��������������ϵ��ȷ����______������ĸ����
A �ң���B ��=��C �ң���D ����ȷ��
���𰸡��� ���� 1��2 A A
��������
��1��t2��ʱ���ҵ��ܽ����ȣ���Ϊ���¶��£������н��㣻
��2��t3��ʱ50g���ܽ��Ϊ50g��50g����50gˮ�г��ֻ���ܽ�25g���壬�ܽ��������Һ�DZ�����Һ������Һ���������ܼ���������=25g��50g=1��2��
��3�������ʵ��ܽ�������¶ȵĽ��Ͷ�������ı�����Һ��t3�潵�µ�t2�棬����������������һ���ᷢ���ı���ǣ��ܽ�ȣ����ʵ����������ʵ��������������䣻��ѡ��A��
��4���ֱ��ҡ����������ʵı�����Һ��100g��t3�潵��t1�棬�ҵ��ܽ�ȼ�С���о�����������������������С�������ܽ���������������������䣬t1��ʱ�ҵ��ܽ�ȴ���t3������ܽ�ȣ����º��ҡ���������Һ��������������ϵ��ȷ�����ң������ʴ�Ϊ��A��

����Ŀ��Ϊ̽������Ļ�ѧ���ʣ�ij��ѧС����������ʵ�飺
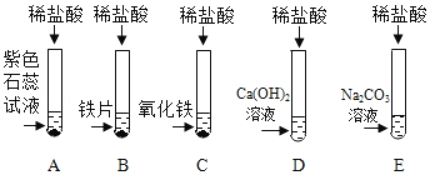
(1)A�Թ��е�ʵ������Ϊ_____��C�Թ�����������Ӧ�Ļ�ѧ����ʽΪ_____��
(2)����Ӧ��D��E�Թ��еķ�Һ����һ���ྻ���ձ��У��۲쵽�ձ����������ݲ��������а�ɫ�������֡����ձ��еĻ������ˣ��õ���ɫ��������ɫ��Һ��ͬѧ�Ƕ���Һ�����ʵijɷֽ���̽����
��������⣩��Һ�����ʵijɷ���ʲô��
���������룩���룺NaCl
�������NaCl��CaCl2
��������_____
�����ģ�NaCl��Ca(OH)2��HCl
���������ۣ��������ۣ�ͬѧ��һ����Ϊ����_____�Ǵ���ġ�
�����ʵ�飩�����ʵ�鱨�档
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Һ���Թ��У��μ�������̼������Һ�� | _____ | ����������� |
ȡ������Һ���Թ��У��μ�_____(������)�� | _____ | ���������� |
��Ǩ����չ��ϡ���ᡢϡ������һЩ���ƵĻ�ѧ���ʣ�����Ϊ�ڲ�ͬ������Һ�ж�����_____��
����Ŀ����֪���ֽⷴӦ![]() �ɽ��С��ڳ����£������ͬŨ�ȵ�����������Һ��pH���������ݽ�ʾ�����ֽⷴӦ��һ�����ɣ������Խ�ǿ�����ʷ������Ʒ�Ӧ�������ɼ����������ʡ����ոù��ɣ������ж����з�Ӧ���ܳ�������
�ɽ��С��ڳ����£������ͬŨ�ȵ�����������Һ��pH���������ݽ�ʾ�����ֽⷴӦ��һ�����ɣ������Խ�ǿ�����ʷ������Ʒ�Ӧ�������ɼ����������ʡ����ոù��ɣ������ж����з�Ӧ���ܳ�������
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 8.6 | 11.6 | 10.3 | 11.1 |
A.![]()
B.![]()
C.![]()
D.![]()